 |
"использование днк-технологий в медицине: методы ПЦР и секвенирования. Генная терапия"
|
|
|
|
" ИСПОЛЬЗОВАНИЕ ДНК-ТЕХНОЛОГИЙ В МЕДИЦИНЕ: МЕТОДЫ ПЦР И СЕКВЕНИРОВАНИЯ. ГЕННАЯ ТЕРАПИЯ"
План:
1. Полимеразная цепная реакция (классическая ПЦР, ПЦР в реальном времени, мостиковая ПЦР, эмульсионная ПЦР, цифровая капельная ПЦР)
2. Оборудование и материалы для ПЦР (Типы ПЦР-амплификаторов, Формат пробирок для проведения ПЦР, " Горячий старт" )
3. Методы секвенирования нуклеиновых кислот (Максама-Гилберта, Сэнгера) 4. Методы высокопроизводительного секвенирования нового поколения (NGS) (Метод гибридизации на твердой фазе, MALDI-TOF-секвенирование, секвенирование лигированием, пиросеквенирование, метод обратимых терминирующих нуклеотидов, полупроводниковое секвенирование, нанопоровое секвенирование)
5. Секвенирование генома человека (метод " дробовика", метод " клон-за-клоном" )
6. Генная терапия
7. Типы генотерапевтических вмешательств и выбор клеток-мишеней
8. Методы генетической трансфекции в генной терапии
9. Коструирование векторных систем для трансфекции клеток человека (Физико-химические методы переноса чужеродной ДНК в клетки эукариот, липосомный метод трансфекции, рекомбинантные вирусы)
1. Полимеразная цепная реакция (ПЦР)
 Ранее, клонирование с использованием библиотек ДНК было единственным способом изолировать ген или исследуемый фрагмент ДНК. Этот подход и в настоящее время сохраняет свою актуальность при полногеномном секвенировании, а также при работе с очень большими генами. Гораздо более быструю и простую альтернативу для многих приложений клонирования, в особенности для тех организмов, чьи полные последовательности геномов секвенированы, предлагает метод полимеразной цепной реакции (ПЦР) (polymerase chain reaction, PCR), предложенный в 1983 г. сотрудником компании " Cetus" Кэри Муллисом, удостоенным за данное изобретение Нобелевской премии по химии. В настоящее время, метод ПЦР в той или иной его модификации является неотъемлемой частью любого молекулярно-биологического исследования. В медицине ПЦР применяют для диагностики инфекционных и наследственных заболеваний, при диагностике рака и иммунных патологий. В криминалистике и судебной медицине ПЦР используют для идентификации личности, определения биологического родства индивидов и анализе образцов биологического материала, собранного на месте преступления. Санитарно-эпидемиологические службы используют ПЦР для контроля за микробиологическим загрязнением окружающей среды и продуктов питания, а также для выявления генетически модифицированных продуктов (ГМО). В научно-исследовательских лабораториях, ПЦР используют для изучения нуклеиновых кислот и проведения манипуляций с ними. Благодаря ПЦР стало возможным быстрое получение участков ДНК в чистом виде и достаточном количестве. На основе ПЦР были созданы современные технологии секвенирования нуклеиновых кислот (ДНК и РНК). Внедрение ПЦР в медицину открыло новое диагностическое направление - ДНК-диагностику.
Ранее, клонирование с использованием библиотек ДНК было единственным способом изолировать ген или исследуемый фрагмент ДНК. Этот подход и в настоящее время сохраняет свою актуальность при полногеномном секвенировании, а также при работе с очень большими генами. Гораздо более быструю и простую альтернативу для многих приложений клонирования, в особенности для тех организмов, чьи полные последовательности геномов секвенированы, предлагает метод полимеразной цепной реакции (ПЦР) (polymerase chain reaction, PCR), предложенный в 1983 г. сотрудником компании " Cetus" Кэри Муллисом, удостоенным за данное изобретение Нобелевской премии по химии. В настоящее время, метод ПЦР в той или иной его модификации является неотъемлемой частью любого молекулярно-биологического исследования. В медицине ПЦР применяют для диагностики инфекционных и наследственных заболеваний, при диагностике рака и иммунных патологий. В криминалистике и судебной медицине ПЦР используют для идентификации личности, определения биологического родства индивидов и анализе образцов биологического материала, собранного на месте преступления. Санитарно-эпидемиологические службы используют ПЦР для контроля за микробиологическим загрязнением окружающей среды и продуктов питания, а также для выявления генетически модифицированных продуктов (ГМО). В научно-исследовательских лабораториях, ПЦР используют для изучения нуклеиновых кислот и проведения манипуляций с ними. Благодаря ПЦР стало возможным быстрое получение участков ДНК в чистом виде и достаточном количестве. На основе ПЦР были созданы современные технологии секвенирования нуклеиновых кислот (ДНК и РНК). Внедрение ПЦР в медицину открыло новое диагностическое направление - ДНК-диагностику.
|
|
|
В настоящее время существует множество модификаций ПЦР: ПЦР в реальном времени, количественная ПЦР (quantitative, qPCR), мостиковая ПЦР (bridge PCR, bPCR), эмульсионная (emulsion PCR, ePCR) и цифровая капельная ПЦР (digital drop PCR, ddPCR). Несмотря на большое разнообразие отдельных подходов, в основе всех разновидностей метода ПЦР лежит общий принцип способности нуклеиновых кислот к самокопированию (репликации). Поэтому рассмотрение биологических основ и отличительных особенностей каждого из этих методов следует начать с рассмотрения принципа классической ПЦР.
1. 1 Классическая ПЦР
|
|
|
 ПЦР может быть проведена целиком in vitro в бесклеточной среде. С помощью этого метода заданную нуклеотидную последовательность можно выборочно и быстро реплицировать в больших количествах из любого образца ДНК. ПЦР основана на использовании ДНК-полимеразы для копирования образца ДНК в повторяющихся циклах репликации. ДНК-полимеразу направляют к необходимой последовательности короткие ДНК-праймеры (затравки), представляющие собой короткие (18-24 нуклеотида) искусственно синтезированные ДНК-олигонуклеотиды, которые добавляют в реакционную смесь, где они гибридизуются с образцом ДНК в начале и в конце необходимой последовательности. Эти праймеры предоставляют 3ʹ -концы для ДНК-полимеразы, с которых она начинает репликацию обеих цепей. Последовательность самих праймеров необходимо подобрать таким образом, чтобы они были комплементарны участкам ДНК, фланкирующим (т. е. ограничивающим) необходимую последовательность. В настоящее время задача по " дизайну" праймеров может быть решена с помощью специальных компьютерных программ, предназначенных для анализа биологических последовательностей, таких как, например, Primer3, Primer Express и Vector NT. В последнее время, бурное развитие биоинформатики предоставляет все больше возможностей для быстрого и автоматизированного анализа последовательностей генов любого организма, чей геном секвенирован и занесен в соответствующие биоинформационные базы данных, такие как GenBank и NCBI. Синтез праймеров в настоящее время также полностью автоматизирован и осуществляется с помощью специальных приборов - синтезаторов ДНК. В настоящее время задача по синтезу праймеров является рутинной и данная услуга предоставляется многими коммерческими компаниями, действующими на рынке биотехнологий: Синтол, Евроген, Invitrogen, Sigma Aldrich, Cell Signaling. Поскольку праймеры должны быть комплементарны к участкам ДНК, ограничивающим амплифицируемый фрагмент, ПЦР можно использовать только для амплификации последовательности, начало и конец которой известны. В ходе каждого цикла репликации две цепи двухцепочечной ДНК разделяются и копируются независимо.
ПЦР может быть проведена целиком in vitro в бесклеточной среде. С помощью этого метода заданную нуклеотидную последовательность можно выборочно и быстро реплицировать в больших количествах из любого образца ДНК. ПЦР основана на использовании ДНК-полимеразы для копирования образца ДНК в повторяющихся циклах репликации. ДНК-полимеразу направляют к необходимой последовательности короткие ДНК-праймеры (затравки), представляющие собой короткие (18-24 нуклеотида) искусственно синтезированные ДНК-олигонуклеотиды, которые добавляют в реакционную смесь, где они гибридизуются с образцом ДНК в начале и в конце необходимой последовательности. Эти праймеры предоставляют 3ʹ -концы для ДНК-полимеразы, с которых она начинает репликацию обеих цепей. Последовательность самих праймеров необходимо подобрать таким образом, чтобы они были комплементарны участкам ДНК, фланкирующим (т. е. ограничивающим) необходимую последовательность. В настоящее время задача по " дизайну" праймеров может быть решена с помощью специальных компьютерных программ, предназначенных для анализа биологических последовательностей, таких как, например, Primer3, Primer Express и Vector NT. В последнее время, бурное развитие биоинформатики предоставляет все больше возможностей для быстрого и автоматизированного анализа последовательностей генов любого организма, чей геном секвенирован и занесен в соответствующие биоинформационные базы данных, такие как GenBank и NCBI. Синтез праймеров в настоящее время также полностью автоматизирован и осуществляется с помощью специальных приборов - синтезаторов ДНК. В настоящее время задача по синтезу праймеров является рутинной и данная услуга предоставляется многими коммерческими компаниями, действующими на рынке биотехнологий: Синтол, Евроген, Invitrogen, Sigma Aldrich, Cell Signaling. Поскольку праймеры должны быть комплементарны к участкам ДНК, ограничивающим амплифицируемый фрагмент, ПЦР можно использовать только для амплификации последовательности, начало и конец которой известны. В ходе каждого цикла репликации две цепи двухцепочечной ДНК разделяются и копируются независимо.
Каждый цикл ПЦР включает три этапа (Рис. 1). Сначала двухцепочечную ДНК ненадолго нагревают до 90-96°С, чтобы отделить цепи друг от друга (плавление ДНК). Температура плавления каждого образца ДНК индивидуальна и определяется соотношением G≡ C и А=Т пар в первичной структуре амплифицируемого фрагмента. Как известно, при образовании Уотсон-Криковских пар между азотистыми основаниями, между G и C формируется три водородные связи, тогда как пара А=Т образована двумя водородными связями. Поэтому, чем выше содержание G≡ C пар в первичной структуре нуклеиновой кислоты, тем выше ее температура плавления (Tm). Приблизительную температуру плавления короткого фрагмента двухцепочечной ДНК можно рассчитать по уравнению:
|
|
|
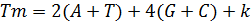 , где
, где
k - число, находящееся в интервале 0< k< 5. Обычно принимают k = 4.

|
|
|


