 |
Физические и химические свойства нитросоединений.
|
|
|
|


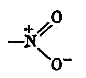 Электронное строение нитрогруппы характеризуется наличие семи полярной (полуполярной) связи:
Электронное строение нитрогруппы характеризуется наличие семи полярной (полуполярной) связи:
или
Нитросоединения жирного ряда – жидкости, не растворимые в воде, хорошо растворимы в спирте и эфире. Ароматические нитросоединения – жидкости или твердые вещества со специфическим запахом. Очень важным свойством нитросоединений – при восстановлении переходить в первичные амины.
С6Н5 - NO2 + 6 [H]  С6Н5 – NH2 + 2 Н2О
С6Н5 – NH2 + 2 Н2О
Все нитросоединения ядовиты. Многие ароматические нитросоединения обладают взрывчатыми свойствами.
Химические свойства. Химическое поведение нитросоединений определяется наличием в молекуле нитрогруппы и ее особенностями, а также строением углеводородного радикала и их взаимным влиянием.

1. Восстановление нитросоединений. При восстановлении нитросоединений образуются первичные амины. Особенно большое промышленное значение имеет восстановление ароматических нитросоединений:
В зависимости от условий восстановления (в кислой, щелочной или нейтральной средах) и характера восстановителя в ходе реакции образуются различные промежуточные продукты, многие из которых нашли широкое применение в технике.

2. Действие щелочей на нитросоединения. При введении в молекулу углеводорода нитрогруппа вследствие ее электроноакцепторных свойств резко повышает подвижность атомов водорода в α-положении. Первичные и вторичные нитросоединения приобретают способность растворяться в щелочах с образованием солей. При действии на соль кислоты образуется нитросоединение в ацинитро-форме:

которая затем переходит в нитро-форму:
Взаимное превращение двух форм нитросоединений является типичным примером динамической изомерии (таутомерии).
|
|
|
3. Реакции бензольного ядра ароматических нитросоединений, Нитрогруппа ориентирует вхождение второго заместителя при электрофильном замещении предпочтительно в ж-положение, при нуклеофильном — в о- и n-положения. Примером производных нитросоединений ароматических углеводородов является 2, 4, 6-тринитрофенол (пикриновая кислота):
Пикриновая кислота и ее соли применяются в качестве взрывчатых веществ и в аналитической химии.

Применение. Нитропарафины применяются в промышленности в качестве растворителей, добавок к дизельным топливам, снижающих температуру их воспламенения, при производстве взрывчатых веществ, пластмасс, в реактивной технике; в качестве полупродуктов в синтезе аминов, альдегидов и кетонов, жирных кислот. Ароматические нитросоединения широко применяются для получения красителей, пластмасс, душистых и взрывчатых веществ.
Отдельные представители.
Нитрометан С Н3—NO2. Жидкость, tкип—101,2 °С. Применяется в качестве растворителя, как ракетное топливо. Хлорированием нитрометана получают трихлорнитрометан (хлорпикрин) CCl3NO2, который применяется для борьбы с грызунами в хлебохранилищах и складах, а также в разнообразных синтезах.

Нитроэтан СН3СН2 -NO2. Жидкость, tкип = 113 °С *Кип=ПЗ°С. Применяется для получения гидроксиламина:
Нитроциклогексан C6СH2NО2. Жидкость, tкип=205 °С. Получают нитрованием циклогексана. Применяется в качестве полупродукта в синтезе капролактама.
Нитробензол C6H6NО2. Жидкость желтоватого цвета, с запахом горького миндаля, tкип = 211 °С. Плохо растворим в воде и хорошо растворим во многих органических растворителях. Исходный продукт в производстве анилина, широко применяется в анилино-красочной, парфюмерной, фармацевтической промышленностях.

Тринитротолуол ( тол, тротил)
Твердое вещество, tпл = 80°С. Широко применяется в качестве взрывчатого вещества.
|
|
|
|
|
|


