 |
Ситуационные задачи для контроля усвоения темы
|
|
|
|
1. На примерах гидролиза AlCl3 и Al2S3 покажите различие в реакциях гидролиза этих солей.
2. Оцените, какую среду создают водные растворы солей: K2SO3, CrCl3, NaCl, CH3COONH4. При помощи молекулярных и ионных уравнений покажите создаваемую среду в случаях гидролиза.
3. Пользуясь знаниями по теме: «Химическая термодинамика» объясните биологическую роль гидролиза АТФ в организме.
4. Рассчитайте степень диссоциации 0,01 М и 0,0001 М растворов Н2SO3 по первом ступени пользуясь соответствующими значениями констант диссоциации.
5. Как изменится рН 0,01 М раствора NH3 при разбавлении в 10 раз?
6. Раствор HNO2 имеет значение рН=3,0. Пользуясь соответствующей формулой и константой диссоциации HNO2, рассчитайте концентрацию кислоты.
7. Оцените константу, степень гидролиза и рН полученного раствора при растворении 0,2 моль Na2S в 2 л воды по первой ступени.
8. Какой из электролитов имеет максимальную, а какой – минимальную степень ионизации, при условии, что каждый из них находится в растворе с концентрацией 0,01 моль/л: а) HCN; б) NH3; в) CH3COOH; г) HNO3; д) Na2HPO4.
9. В какой последовательности уменьшаются значения рН водных растворов с одинаковой концентрацией для следующих веществ: а) HF; б) CH3COOH; в) HCN; г) HCl; д) NH3.
10. Какая из 3-х солей будет подвергаться гидролизу в большей степени (при прочих равных условиях): сульфит натрия, сульфид калия, карбонат цезия по первой ступени. Ответ обоснуйте расчетом.
Домашнее задание
Тема: «Протолитические процессы в буферных растворах».
Литература: [1] с. 108; [3] с. 130; [4] с. 41.
ЗАНЯТИЕ №13
Тема: Протолитические процессы в буферных растворах.
Актуальность темы: В результате жизнедеятельности в организме ежесуточно образуется большое количество кислот. Во-первых, при усвоении белков, жиров и углеводов образуется углекислота, ежесуточно – 13 моль. Помимо угольной кислоты образуются другие органические и минеральные кислоты, при смешанной диете – до 100 ммоль эквивалента. Например, при усвоении 100 г белка выделяется 60 ммоль эквивалента серной кислоты.
|
|
|
Образование кислот характерно для некоторых патологических процессов. При диабетическом кетозе образуется до 1 моль эквивалента ацетоуксусной и b-оксимасляной кислот. Кислоты в организме образуются и в результате приема внутрь некоторых лекарственных препаратов.
Все выделяющиеся кислоты утилизируются тем или иным способом: кислотные остатки фосфорной кислоты образуют органические фосфаты и входят в состав буферных систем крови и тканей, избыток выводится с мочой. Сульфат-ион образует сложные эфиры, которые выводятся почками. Молочная кислота либо окисляется до СО2, либо превращается в гликоген.
Физико-химические расчеты показывают, что 0,15 моль СО2 достаточно для того, чтобы нарушить кислотно-основное равновесие организма человека массой 75 кг. Однако в норме организм способен утилизировать до 13 моль выделяющегося ежесуточно СО2 без нарушения кислотно-основного равновесия. В этом наряду с физиологическими механизмами важную роль играют физико-химические механизмы. Среди последних важное значение имеет буферное действие, которое обеспечивается такими буферными системами, как гидрокарбонатная, гемоглобиновая, фосфатная и белковая. При нарушении кислотно-основного равновесия в организме уже через 10-15 минут включается буферная компенсация, которая затем подключает почечную и легочную компенсацию.
Учебные цели: ознакомиться приготовлением и определением емкости буферных растворов как систем, обеспечивающих кислотно-основный гомеостаз в живых организмах.
В результате освоения темы студент должен уметь:
|
|
|
· Отличать буферные системы от других систем;
· Показывать механизм буферного действия;
· Рассчитывать рН буферных систем, буферную емкость и соотношение компонентов в буферных растворах;
· Готовить простейшие буферные растворы и определять их буферную емкость по кислоте и по щелочи.
Для формирования умений студент должен знать:
· Протолитическую теорию кислот и оснований;
· Протолитические процессы в буферных растворах и механизм буферного действия;
· Расчетные формулы Гендерсона-Гассельбаха для оценки рН буферных растворов и буферной емкости;
· Значение буферных систем в жизнедеятельности и важнейшие буферные системы организма человека.
Вид занятий: лабораторно-практическое.
Продолжительность занятия: 3 академических часа.
Оснащение рабочего места: штатив с пробирками, мерные пипетки, мерная пробирка, бюретка на 25 мл, калькулятор, таблица физико-химических величин, коническая колба.
Реактивы: 0,1 моль/л растворы NaOH, HCI, CH3COOH и СН3СООNa, индикаторы метиловый красный и метиловый оранжевый, дистиллированная вода.
Содержание занятия
1. Контроль исходного уровня знаний (тест).
2. Разбор теоретических вопросов и решение типовых задач.
3. Выполнение лабораторной работы;
а) приготовление ацетатного буфера и оценка рН этих растворов;
б) влияние разбавления на значение рН раствора;
в) определение буферной емкости для ацетатного буфера по кислоте и по щелочи.
4. Проверка протоколов лабораторных работ.
5. Выходной контроль по решению ситуационных задач
6. Задание на дом: «Рубежная контрольная работа по блоку III».
Вопросы для подготовки к занятию
1. Дайте определение буферных растворов и их классификацию.
2. Как можно приготовить буферные растворы?
3. В чем механизм буферного действия? Покажите это на примерах ацетатного и фосфатного буферов.
4. Как рассчитывают рН буферных растворов различных типов по уравнениям Гендерсона-Гассельбаха?
5. От каких факторов зависит рН буферных растворов?
6. Что такое зона буферного действия? Как ее оценивают?
7. Что такое буферная емкость? Как ее рассчитывают по кислоте и по щелочи?
8. От чего зависит буферная емкость?
9. Какие буферные системы содержатся в организме человека? Какая из них обладает наибольшей буферной емкостью?
|
|
|
10. Какие механизмы обеспечивают постоянство рН биосред организма?
11. Какие пары образуют буферные растворы:
а) 50 мл 0,1 М NaOH и 20 мл 0,2 М СН3СООН
б) 50 мл 0,1 М H2SO4 и 100 мл 0,05 М NaOH
в) 50 мл 0,1 М НС1 и 40 мл 0,1 М CH3COONa
г) 20 мл 0,1 М CH3COONa и 30 мл 0,1 М СН3СООН
12. При определении альбумина по реакции с бромкрезоловым зеленым применяют ацетатный буфер. Уксусную кислоту объемом 50 мл смешивают с 13,2 мл раствора гидроксида натрия (концентрация каждого раствора равна 1 моль/л) и объем доводят дистиллированной водой до 1 литра. Вычислите рН используемого раствора.
13. Рассчитайте молярное соотношение компонентов буферной системы, содержащей аммиак и хлорид аммония, имеющей рН=9,8, если рК 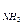 =4,75.
=4,75.
14. Как изменится рН фосфатного буфера, содержащего 12 мл 0,05 М гидрофосфата натрия и 8 мл 0,05 М дигидрофосфата натрия, после добавления 2 мл 0,05 М раствора NaOH?
Литература:
[1] с. 108; [3] с. 130; [4] с. 41.
Дополнительная:
1. Лекционный материал.
2. Ахметов Н.С. Общая и неорганическая химия. -М., Высшая школа. 2002.
|
|
|


