 |
Образец билета входного тест-контроля
|
|
|
|
1. Электролитами являются:
А) C2H5OH Б) NaOH В) CH3COOH
Г) SiO2 Д) CaCI2
Ответ: Б,В,Д.
2. При диссоциации 1 моль Cr2(SO4)3 образуется:
А) 2 моль иона Б) 3 моль иона В) 5 моль иона
Г) 6 моль иона Д) 4 моль иона.
Ответ: В.
3. Первую теорию диссоциации электролитов создал:
А) Аррениус Б) Дебай В) Каблуков
Г) Менделеев Д) Оствальд
Ответ: А.
4. Степень диссоциации электролита зависит от:
А) температуры Б) природы растворителя
В) времени Г) концентрации
Д) присутствия одноименных ионов Е) давления
Ответ: А,Б,Г,Д.
5. Ионы, участвующие в реакции NaHCO3 + HCI = NaCI + CO2 + H2O:
А) Na+ Б) CI- В) H+
Г) CO  Д) HCO
Д) HCO 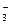
Ответ: В,Д.
6. Какие реакции протекают до конца?
А) CuCI2+Na2SO4 Б) BaCI2+Sr(NO3)2 В) SrCI2+Li2SO4
Г) (NH4)2C2O4+CaCI2 Д) CH3COONa+H2SO4
Ответ: В,Г,Д.
7. Степень диссоциации слабого электролита при увеличении концентрации его:
А) возрастает
Б) не меняется
В) уменьшается
Г) сначала возрастает, затем остается постоянной
Д) сначала уменьшается, затем возрастает
Ответ: В.
8. Какой из электролитов при их одинаковой концентрации имеет более низкую ионную силу:
А) K2SO4
Б) KCI
В) CaCI2
Г) CuSO4
Д) AI2(SO4)3
Ответ: Б.
9. Сумма коэффициентов в левой части для сокращенного ионного уравнения реакции CaCI2 + K3PO4 → Ca3(PO4)2 + KCI:
А) 2 Б) 4 В) 5 Г) 3 Д) 6
Ответ: В.
10. Даны 2 раствора: 1) 0,1 м CH3COOH и 2) 0,1м C2H5OH. Осмотические давления этих растворов соотносятся:
А) P1 > P2 Б) P2 > P1 В) P1 = P2
Ответ: А.
Информационная часть
Электролитами называются проводящие электрический ток расплавы, растворы и сами вещества. Все вещества по их поведению в растворах делят на 2 группы:
· вещества, растворы которых проводят электрический ток (электролиты);
· вещества, растворы которых не обладают электропроводностью (неэлектролиты).
К электролитам относится большинство неорганических кислот, оснований и солей. Изучая свойства растворов электролитов Вант-Гофф обнаружил, что они обладают боле низкими значениями температуры плавления и более высокими температурами кипения по сравнению с соответствующими значениями для чистого растворителя или для раствора неэлектролита в этом же растворителе при тех же концентрациях. Для объяснения этих фактов шведский ученый С. Аррениус в 1887 г. предложил теорию электролитической диссоциации. Распад молекул электролитов на ионы в растворителях называют электролитической диссоциацией или ионизацией. При этом образуются положительно заряженные ионы – катионы и отрицательно заряженные ионы – анионы.
|
|
|
Процесс диссоциации является обратимым. Различные электролиты диссоциируют на ионы в различной степени. Полнота распада зависит от природы электролита, его концентрации, температуры, природы растворителя, присутствия одноименных и других ионов и веществ.
В развитии теории С. Аррениуса значительна роль русских ученых И.А. Каблукова и В.А. Кистяковского, которые показали роль сольватации молекул в процессе диссоциации их на ионы. Роль растворителя заключается не только в создании условий для поляризации и разделения ионов противоположного знака, но и в замедлении их рекомбинации. Перешедшие в раствор ионы сольватированы (в случае воды – гидратированы), и в результате диссоциации образуются относительно устойчивые соединения ионов с молекулами растворителя – сольваты ионов (гидраты ионов). Число молекул растворителя в сольватной оболочке непостоянно, а зависит от природы ионов, температуры и концентрации раствора. При написании уравнений диссоциации, а также ионных уравнений, обычно сольватную оболочку не указывают. Например,
CH3COOH «CH3COO- + H+
или CaCO3 + 2H+ = Ca2+ + CO2 + H2O.
Важной характеристикой любого электролита является степен ь его диссоциации (или степень ионизации).
|
|
|
Степень диссоциации – это отношение числа молекул вещества, распавшихся на ионы, к общему числу его молекул в растворе.
Это количественная характеристика силы электролита.
 или
или  ,
,
т.к. концентрация пропорциональна числу молекул и ионов в растворе. Степень диссоциации выражается в долях или процентах.
Все электролиты условно делятся на:
· сильные электролиты, если α ≥ 30%;
· слабые электролиты, если α ≤ 3%;
· электролиты средней силы, если 3%<α<30%.
Экспериментально степень диссоциации (α) определяют, измеряя отклонения коллигативных свойств растворов электролитов от теоретических значений для идеальных растворов (через изотонический коэффициент):
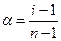 , где
, где
n – число ионов, на которые распадаются молекулы,
i – изотонический коэффициент.
На степень диссоциации влияют:
· Температура. Как правило, для большинства электролитов степень диссоциации возрастает с температурой.
· Концентрация раствора. С увеличением концентрации степень диссоциации уменьшается.
· Одноименные ионы. Введение одноименных ионов приводит к уменьшению степени диссоциации.
· Посторонние сильные электролиты. Обычно приводят к некоторому увеличению степени диссоциации, из-за увеличения ионной силы раствора.
Количественно электролитическую диссоциацию можно выразить также через константу диссоциации, которая получается путем применения закона действующих масс к обратимому процессу диссоциации. Так для слабых электролитов В. Оствальд установил связь между константой диссоциации и степенью диссоциации. Эта зависимость получила название закона разведения Оствальда. Математическое выражение его:
 , где
, где
K – константа диссоциации;
a – степень диссоциации;
с – концентрация электролита.
Для очень разбавленных растворов, когда c → 0 имеем  . Если ввести
. Если ввести  =V (разбавление), то
=V (разбавление), то  .
.
|
|
|


