 |
Степень диссоциации слабого электролита возрастает с разбавлением раствора.
|
|
|
|
Сильные электролиты не подчиняются закону разведения Оствальда.
Многоосновные кислоты и многокислотные основания диссоциируют в растворах ступенчато. Например, для H3PO4:
H3PO4 «H+ + H2PO  K1
K1
H2PO  «H+ + HPO
«H+ + HPO  K2
K2
HPO  «H+ + PO
«H+ + PO  K3
K3
По первой ступени H3PO4 – кислота средней силы, а по второй и третьей ступеням – слабая. Суммарно это можно показать:
H3PO4 «3H+ + PO  Kобщ
Kобщ
Математически можно показать, что:
Kобщ=K1∙K2∙K3.
Для характеристики силы электролита пользуются также показателем константы диссоциации (pK):
рК = -lgK
Чем больше значение pK, тем электролит слабее и наоборот.
Практически полная диссоциация сильных электролитов на ионы вне зависимости от концентрации их растворов подтверждается физическими и физико-химическими методами исследования.
В 1923 г П. Дебай и Э. Хюккель установили закон ионной силы.
В разбавленных растворах сильных электролитов с одинаковой ионной силой коэффициенты активности катионов и анионов одинаковой зарядности равны независимо от их химической природы.
Математическое выражение закона ионной силы имеет вид:
 , где
, где
f – коэффициент активности;
z – заряд катиона или аниона;
J – ионная силы раствора.
Ионной силой раствора называют полусумму произведения концентраций всех находящихся в растворе ионов на квадрат их заряда.
 , где
, где
сi – концентрация ионов;
zi – их заряд;
i – число ионов.
Зная ионную силу можно рассчитать коэффициент активности, а последний позволяет найти активность ионов (а) в растворе.
а = f × c, где
f – коэффициент активности;
с – концентрация иона.
Активность иона – эта эффективная концентрация его, в соответствии с которой он участвует в различных процессах. Активность имеет такую же размерность, что и концентрация (моль/л).
|
|
|
Отклонение активности от концентрации возникает за счет образования вокруг каждого иона так называемой «ионной атмосферы» из противоположно заряженных ионов. Ионная атмосфера тормозит движение иона и уменьшает его подвижность. При бесконечном разведении с ® 0 имеем а = с, т.к. f = 1. В очень разбавленных растворах сильных электролитов можно принять а» с.
Поскольку электролиты в растворах образуют ионы, то для отражения сущности реакции часто используют так называемые ионные уравнения. Последние подчеркивают тот факт, что в растворах происходят реакции не между молекулами, а между ионами.
Согласно теории электролитической диссоциации при реакциях в растворах электролитов возможны 2 варианта:
· Образующиеся вещества – сильные электролиты, хорошо растворимые в воде и полностью диссоциирующие на ионы.
· Одно или несколько из образующихся веществ – газ, осадок или хорошо растворимый в воде слабый электролит.
K2CO3 + H2SO4 = K2SO4 + CO2 + H2O
2K+ + CO  + 2H+ + SO
+ 2H+ + SO  = 2K+ + SO
= 2K+ + SO  + CO2 + H2O
+ CO2 + H2O
CO  + 2H+ = CO2 + H2O
+ 2H+ = CO2 + H2O
Последнее уравнение называют сокращенным ионным уравнением реакции, которое получается после сокращения повторяющихся ионов. Сокращенное ионное уравнение показывает, что при действии на любые растворимые карбонаты сильными кислотами выделяются СО2 и Н2О.
В этом практическая ценность сокращенных ионных уравнений, их широко используют как качественные реакции на различные ионы.
Из рассмотренного выше материала, можно вывести правило: «Реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов». Это правило справедливо для разбавленных водных растворов при комнатной температуре.
Разбор типовых задач
1. Из приведенных веществ выберите те, которые в водных растворах диссоциируют на ионы. Напишите возможные реакции между этими веществами в водных растворах в молекулярном и ионном видах: глюкоза, формиат калия, соляная кислота, гидроксид кальция, ацетон, сульфат железа (III).
|
|
|
Решение: Из приведенных веществ на ионы диссоциируют формиат калия, соляная кислота, гидроксид кальция и сульфат железа (III). В водных растворах возможны реакции:
1) НСООК + НС1 = НСООН + КС1 или
НСОО- + Н+ = НСООН
2) 2НС1 + Са(ОН)2 = СаС12 + 2Н2О или
2Н+ + Са(ОН)2 = Са2+ + 2Н2О
3) 3Са(ОН)2 + Fe2(SO4)3 = 2Fe(OH)3¯ + 3CaSO4¯ или
3Са(ОН)2 + 2Fe3+ + 3SO  = 2Fe(OH)3¯ + 3CaSO4¯
= 2Fe(OH)3¯ + 3CaSO4¯
Эти реакции возможны потому, что в первом случае образуется слабый электролит НСООН, во втором случае – Н2О, а в третьем случае образуются осадки Fe(OH)3 и CaSO4.
2. Запишите выражения для констант диссоциации слабого основания Zn(OH)2 по отдельным ступеням. По какой из ступеней диссоциация происходит сильнее?
Решение: Молекулы многоосновных кислот и многокислотных оснований диссоциируют ступенчато, и каждая равновесная стадия характеризуется своей константой равновесия – константой диссоциации:
1-ая ступень Zn(OH)2 «Zn(OH)+ + OH-

2-ая ступень Zn(OH)+ «Zn2+ + OH-
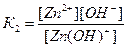
В результате 1-ой ступени ОН- - ионы отщепляются от нейтральной молекулы Zn(OH)2, в результате 2-ой ступени частица ОН- отщепляется уже от положительно заряженного иона Zn(OH)+, что, очевидно, требует гораздо большей затраты энергии. Поэтому количество ионов, образующихся по 2-ой стадии будет значительно меньше, чем по 1-ой, т.е. диссоциация протекает в меньшей степени. Этот качественный вывод подтверждается численными значениями соответствующих констант диссоциации: К1=4,4×10-5; К2=1,5×10-9. Итак, К1>К2.
3. Оцените степень диссоциации в 0,005 М и 0,05 М растворах H2SO3.
Решение: Для решения следует использовать закон разведения Оствальда и значения констант диссоциации Н2SO3. Сернистая кислота – слабый электролит, диссоциирует ступенчато:
H2SO3 «H+ + HSO 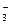 К1 = 1,7×10-2
К1 = 1,7×10-2
HSO 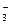 «H+ + SO
«H+ + SO  К2 = 6,3×10-8
К2 = 6,3×10-8
Поскольку К2<<К1, то диссоциацией кислоты по 2-ой ступени можно в первом приближении пренебречь и рассчитывать a для 1-ой ступени диссоциации. С другой стороны, значение К1 относительно велико (>10-4), поэтому расчет a следует проводить по полной формуле Оствальда:
 или сa2 + ka - k = 0
или сa2 + ka - k = 0
Для 0,005 М раствора:
|
|
|

Расчет по приближенной формуле (K»α2c) приводит к величине α>1, что не имеет смысла.
Для 0,05 М раствора:

Видно, что с уменьшением концентрации слабого электролита α увеличивается. При бесконечном разбавлении раствора степень диссоциации стремится к единице: α∞→1.
4. Чему равна ионная сила раствора, содержащего 2,5 г CaC12 и 1,5 г NaC1 в 0,5 л раствора?
Решение: Ионная сила такого раствора рассчитывается по формуле:

Концентрации ионов молярные, поэтому подсчитаем молярные концентрации солей по формуле:

 ;
; 
СаС12 и NaС1 сильные электролиты, приняв, что при таких концентрациях они диссоциируют полностью, имеем:
СаС12 = Са2+ + 2С1-
NaCl = Na+ + С1-
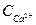 = 0,045 моль/л;
= 0,045 моль/л;  = 0,051 моль/л;
= 0,051 моль/л;
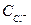 = 2 ∙ 0,045 + 0,051 = 0,141 моль/л.
= 2 ∙ 0,045 + 0,051 = 0,141 моль/л.

Ответ: J = 0,186.
5. Чему равна активность ионов H+ в 0,02 М растворе HNO3?
Решение: Активность ионов рассчитывается по формуле:  , a коэффициент активности – по формуле:
, a коэффициент активности – по формуле: 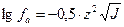 .
.
Рассчитаем сначала ионную силу раствора:

Из HNO3 = H+ + NO  имеем С
имеем С  = 0,02 моль/л; С
= 0,02 моль/л; С  = 0,02 моль/л
= 0,02 моль/л

Затем  или
или  .
.
Окончательно, а 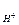 = 0,85 × 0,02 = 0,017 моль/л.
= 0,85 × 0,02 = 0,017 моль/л.
Видно, что активность ионов Н+ несколько меньше его концентрации.
Лабораторная работа
Задание 1. Изучение влияния природы электролита на скорость реакции.
В две пробирки одинакового размера налейте мерной пробиркой по 5 мл 1 М HCl (в первую пробирку) и 1 М CH3COOH (в другую пробирку). В обе пробирки опустите по равному кусочку металлического цинка. Обе пробирки поместите в стакан с горячей водой (60-70°С). Наблюдайте выделение газа (какого?) и отметьте, в какой пробирке газ выделяется более интенсивно. Напишите уравнение протекающих реакций в молекулярной и ионной формах. Дайте объяснение наблюдаемому явлению исходя из зависимости скорости реакции от концентрации реагирующих веществ.
Задание 2. Изучение влияния концентрации электролитов на природу продуктов реакции и на скорость реакции.
В две пробирки одинакового размера налейте по 3 мл (мерной пробиркой) 1 М H2SO4 (в первую пробирку) и концентрированную H2SO4 (во вторую пробирку). В обе пробирки опустите по равному кусочку цинка. Затем обе пробирки поместите в стакан с горячей водой (60-70°С). Наблюдайте выделение газа в каждой пробирке (каких?) и скорость выделения газов. Напишите уравнения протекающих реакций в молекулярном и ионном видах и объясните выделение газов, и скорость их выделения исходя из природы концентрированной и разбавленной серной кислоты в окислительно-восстановительных реакциях и влияния концентрации вещества на скорость реакции.
|
|
|
Задание 3. Изучение влияния природы растворителя на характер диссоциации электролита.
В пробирку внесите 2 мл спиртового раствора хлорида меди (II), обратив внимание на цвет раствора. Содержимое пробирки разделите на 2 равные части. Одну пробирку оставьте для сравнения, а в другую добавьте 2-3 мл дистиллированной воды. Наблюдайте изменение окраски раствора во второй пробирке. Дайте объяснение наблюдаемому явлению, исходя из диэлектрической проницаемости воды (78) и спирта этилового (24).
Задание 4. Изучение влияния одноименных ионов на степень диссоциации электролита.
В две пробирки одинакового размера налейте по 4 мл 0,1 М раствора CH3COOH. В каждую пробирку добавьте по 2 капли индикатора метилового оранжевого. В одну из пробирок микрошпателем внесите несколько кристаллов CH3COONa и раствор перемешайте до полного растворения соли. Отметьте изменение окраски раствора во второй пробирке. Объясните данное явление исходя из закона действия масс. Напишите уравнение реакции ионизации слабого электролита CH3COOH.
|
|
|


