 |
Определение температуры и удельной теплоты плавления вещества
|
|
|
|
Цель работы: определить температуру плавления и удельную теплоту плавления вещества.
Теоретический материал: Понятие о фазе состояния вещества, фазовые переходы в чистых веществах и смесях. Фазовые превращения первого и второго рода. Уравнение Клайперона-Клаузиуса, вывод и физический смысл. Кривые равновесия фаз в различных переменных. Плавление и кристаллизация. Кривая плавления. Метастабильные состояния. Переохлажденные жидкости. Тройная точка. Правило фаз. Изменение энтропии при фазовом переходе I рода.
Фазовые превращения.
Среди микроскопических процессов особую группу составляют фазовые превращения или фазовые переходы, в результате которых свойства тела меняются скачком. Состояния вещества, между которыми происходит фазовый переход, называют его фазами. В этом смысле различными фазами являются, например, агрегатные состояния вещества. Понятие фаз является более широким, чем понятие об агрегатных состояниях, так как различные фазы вещества могут сосуществовать и в пределах одного и того же агрегатного состояния (явление полиморфизма). Фазовые превращения, бывают двух типов.
Фазовым переходом первого рода называют процесс, при котором скачком изменяются плотность, внутренняя энергия; энтропия тела. При этом выделяется или поглощается энергия, называемая теплотой фазового перехода. Примерами фазовых превращений первого рода являются изменения агрегатного состояния вещества: испарение и конденсация, плавление и кристаллизация, возгонка, сублимация. К числу фазовых превращений первого рода относятся также переходы твердого тела из одной кристаллической модификации в другую - полиморфные превращения. Кристаллы при этом отличаются друг от друга только строением кристаллической решетки. Примером таких кристаллов являются графит и алмаз - модификации углерода.
|
|
|
Некоторые вещества способны образовывать так называемые жидкие кристаллы. Жидкие кристаллы текучи, то есть по своим механическим свойствам они схожи с обычными жидкостями. Вместе с тем они обладают упорядоченной структурой, что роднит их с кристаллами. Возникновение упорядоченной структуры сопровождается выделением тепла. Однако теплота плавления жидких кристаллов практически на порядок меньше, чем твердых тел.
Фазовым переходом второго рода называется процесс, в результате которого скачком изменяется зависимость свойств тела от температуры и давления, то есть скачком меняются производные от тепловых характеристик тела по температуре или давлению. Например, скачок испытывает теплоемкость, сжимаемость и другие свойства. При этом плотность, внутренняя анергия, энтропия меняются непрерывным образом. К фазовым переходам второго рода относится также переход жидкого гелия в сверхтекучее состояние при Т = 2,2 К, переход проводников в сверхпроводящее состояние, полиморфные превращения особого типа и др.
Таким образом, для фазовых переходов первого рода характерно скачкообразное, то есть происходящее в очень узком температурном интервале, изменение свойств вещества. Можно, следовательно, говорить об определенной температуре перехода или точке перехода.
|
 Рассмотрим некоторые особенности переходов в твердое состояние. Для того чтобы вещество могло находиться в твердом состоянии, его температура должна быть достаточно низкой, чтобы энергия кТ тепловых движений была меньше, чем потенциальная энергия взаимодействия атомов. В твердое состояние вещество может перейти как из жидкого, так и из газообразного состояния. В обоих случаях такой переход есть переход из состояния лишенного симметрии, в состояние в котором симметрия существует (дальний порядок). П оэтому переход в твердое состояние из жидкого и газообразного состояний и обратный переход должны происходить скачком, то есть при определенной температуре. Эта температура зависит от внешнего давления. Зависимость температуры фазовыхпереходов от давления описывается уравнением Клаперона – Клазиуса:
Рассмотрим некоторые особенности переходов в твердое состояние. Для того чтобы вещество могло находиться в твердом состоянии, его температура должна быть достаточно низкой, чтобы энергия кТ тепловых движений была меньше, чем потенциальная энергия взаимодействия атомов. В твердое состояние вещество может перейти как из жидкого, так и из газообразного состояния. В обоих случаях такой переход есть переход из состояния лишенного симметрии, в состояние в котором симметрия существует (дальний порядок). П оэтому переход в твердое состояние из жидкого и газообразного состояний и обратный переход должны происходить скачком, то есть при определенной температуре. Эта температура зависит от внешнего давления. Зависимость температуры фазовыхпереходов от давления описывается уравнением Клаперона – Клазиуса:|
|
|
 (1)
(1)
 На диаграмме РТ эта зависимость изображена кривыми плавления (I) и сублимации (II). Точка 0 является тройной точкой. Наклоны кривых определяются уравнением (I). Если непрерывно подводить тепло к кристаллическому телу, то температура его будет повиваться. При достижении телом температуры плавления Тпл, начинается превращение кристалла в жидкость. При этом, несмотря на продолжающееся нагревание, температура вещества остаётся постоянной, равной Тпл.
На диаграмме РТ эта зависимость изображена кривыми плавления (I) и сублимации (II). Точка 0 является тройной точкой. Наклоны кривых определяются уравнением (I). Если непрерывно подводить тепло к кристаллическому телу, то температура его будет повиваться. При достижении телом температуры плавления Тпл, начинается превращение кристалла в жидкость. При этом, несмотря на продолжающееся нагревание, температура вещества остаётся постоянной, равной Тпл.
|
 Когда весь кристалл расплавится, температура расплава опять начнет повышаться. Обратный процесс (кристаллизация) идет вдоль той же кривой, но с выделением тепла при Т = Тпл. При нагревании аморфных (некристаллических) тел изменение температуры с течением времени изображается монотонно изменяющейся кривой без плато.
Когда весь кристалл расплавится, температура расплава опять начнет повышаться. Обратный процесс (кристаллизация) идет вдоль той же кривой, но с выделением тепла при Т = Тпл. При нагревании аморфных (некристаллических) тел изменение температуры с течением времени изображается монотонно изменяющейся кривой без плато.
Рассмотрим процесс плавления кристаллического вещества с точки зрения изменения внутренней энергии и энтропии системы частиц, из которых построено тело. В кристаллической решетке, частицы колеблются около положений равновесия, расстояние между которыми соответствуют минимальному значении энергии взаимодействия при данной температуре и максимальному порядку системы. Поскольку мерой неупорядоченности системы является энтропия, то кристаллическому состоянию отвечает минимальная энтропия. При плавлении кристалла пространственная решетка разрушается и дальний порядок в упаковке частиц переходит в ближний, неупорядоченность системы возрастает, растет термодинамическая вероятность w, а значит и энтропия системы S = К lnw. Расстояние между частицами увеличивается, чтo ведет к возрастанию энергии взаимодействия между ними и, следовательно, росту внутренней энергии. Итак, процесс плавления кристалла сопровождается возрастанием его внутренней энергии и энтропии. Естественно, что при этом процессе телу необходимо сообщить некоторую энергию – так называемую теплоту плавления.
|
|
|
Для начала обратного процесса кристаллизации необходимо присутствие центров кристаллизации. Такими центрами могли бы служить случайные скопления частиц жидкости. Однако образование таких скоплений в самой жидкости затрудняется тепловым движением. Кристаллизация существенно облегчается, если в жидкости с самого начала присутствуют достаточно большие твердые частицы в виде пылинок и других тел, которые становятся центрами кристаллизации. Для образования центров кристаллизации я чистой жидкости обычно необходимо заметное понижение температуры. Поэтому кристаллизация чистой жидкости, лишенной посторонних образований, начинается обычно при температуре несколько более низкой, чем истинная температура кристаллизации.
Экспериментальное определение температуры плавления веществ и удельной теплоты плавления базируется на методе непрерывного контроля температуры исследуемого образца в условиях постоянного теплового нагрева. Теоретической основой метода является уравнение теплового баланса. Пусть образец вещества нагревается с помощью электрического нагревателя сопротивлением R, по которому течет ток i. Тогда количество теплоты, выделяемое нагревателем за время Δt
будет:

Если образец достиг температуры плавления Т, то в процессе плавления тепло, поступающее от нагревателя, будет, во-первых, расходоваться на фазовый переход Q1 = λm и, во-вторых, отдаваться образцом за счет теплообмена в окружающую средуQ2= αS(Тпл – TC)Δt. Здесь λ - удельная теплота плавления, m – масса образца, α - коэффициент теплообмена, Тпл – температура плавления, ТС – температура окружающей среды, Δt – время плавления, S – площадь поверхности образца.
В стационарном режиме, для промежутка времени Δt можно записать:
Q=Q1+Q2
Или i 2RT= λm + αS(Тпл – TC)Δt
и, следовательно,
 (2)
(2)
Величину S можно определить следующим образом. Если после перехода твердого тела в жидкость продолжать нагрев расплава, то температура его будет возрастать, однако лишь до определенного предела, определяемого условием, когда воя тепловая мощность нагревателя будет полностью рассеиваться в окружающую среду по закону Ньютона. В этом случае установится постоянная температура расплава и тепловой баланс можно записать так:
|
|
|
α S (Тy – TC)= i2 R,
где Ту – установившаяся температура.
Тогда 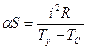
Подставляя последнее выражение в (2) получим формулу определения удельной теплоты плавления по экспериментально измеренным величинам.
 (3)
(3)
Изменение энтропии при плавлении кристаллического образца определяется следующим образом:
 (4)
(4)
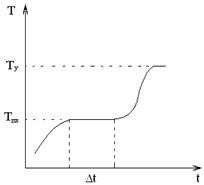
Описание установки. Для определения λ и Тпл необходимо записать изменение температуры образца во времени. Типичная диаграмма представлена на рис. 3 Блок-схема установки изображена на рис. 4.

| |||
| |||
Рабочей частью установки является алюминиевый блок (I), в который вмонтирован электронагреватель. Исследуемое вещество помещается в этот блок и нагревается. Температура образца регистрируется с помощью термопары (2), показания которой автоматически записываются самописцем (3) на диаграммную ленту. Значения температур Ту и Тпл определяют из диаграммы по градуировочному графику, дающему связь между отклонением пера самописца в миллиметрах и температурой в градусах Цельсия. Hагрев образца осуществляется от сети через трансформатор. Величина тока регулируется резистором (4) и фиксируется по показанию амперметра (5). Время плавления легко определить из диаграмм, если известна скорость ее протяжки v по формуле  .
.
Необходимые для расчетов значения величин R, i, m, v, а также порядок выполнения работы и меры безопасности даются в техническом описании установки.
Порядок проведения эксперимента.
1. Перед включением установки необходимо убедиться, что все тумблеры на панели находятся в исходном положении, то есть в положении - "выключено".
2. Убедиться в том, что перо самописца опущено на диаграммную ленту и чернила поступают в пишущий узел.
3. Переключатель рода работ поставить в положение "контроль".
4. Включить тумблер "сеть", при этом должны осветиться камера с образцами и включиться потенциометр. Дать прибору прогреться в течение 2-х - 3-х минут.
5. Открыв дверцу самописца, включить тумблер "диаграмма". Убедиться в том, что перо самописца записывает непрерывную линию.
6. Установить переключатель рода работ в положение “плавление” и включить тумблер "нагрев". Установить ток нагрева -
|
|
|
7. Записать кривую плавления вещества, включающую участок плавления до достижения установившейся температуры. Для экономии диаграммной ленты тумблер "диаграмма" выключить после окончания процесса плавления и включить его снова после достижения установившейся температуры.
8. Ток нагрева на протяжении опыта не должен изменяться. В случае изменения тока плавно подрегулировать его.
9. При достижении установившейся температуры выключить тумблер "нагрев".
10. Записать кривую охлаждения, включая участок кривой кристаллизации.
11. По окончании работы выключить тумблер "диаграмма", тумблер "сеть", поднять перо самописца.
12. Отрезать диаграммную ленту с записанной кривой плавления и кристаллизации вещества. Приступить к обработке результатов измерений.
Данные для расчетов.
I. Исследуемое вещество - кристаллическая сера, масса вещества -
2. Сопротивление нагревателя ~ R = 40м.
3. Скорость протяжки диаграммной ленты 0,2 мм/с.
4. Рабочий ток - 2 А.
КАТЕГОРИЧЕСКИ ЗАПРЕЩАЕТСЯ!
1. Включать установку в сеть без разрешения преподавателя или лаборантов.
2. Открывать защитную крышку во время работы установки.
3. Во время эксперимента оставлять установку без надзора.
4. Самостоятельно устранять любые возникшие во время эксперимента неисправности.
Контрольные вопросы:
1. Что называется фазой в термодинамике? Что такое фазовые равновесия я фазовые переходы? Какая разница между фазовыми переходами первого рода и фазовыми переходами второго рода? Перечислите простейшие фазовые переходы и дайте им определения. Что называется скрытой теплотой фазового перехода? В каких единицах она измеряется? Чем определяется направление фазового перехода?
2. Какие тела называется кристаллическими? Как изменяется во времени температура кристаллического образца при его нагревании? В чем заключается процесс плавления? процесс кристаллизации? Что называется удельной теплотой плавления? удельной теплотой кристаллизации?
3. На чем основан метод определения удельной теплоты плавления вещества в данной работе? Выведите расчетную формулу для удельной теплоты фазового перехода. Какие законы при этом используются?
4. Выведите уравнение Клайперона-Клаузиуса. Какие величины связывают это уравнение? Запишите уравнение Клайперона-Клаузиуса применительно к процессу перехода твердого тела в жидкость. Как зависит температура плавления твердых тел от давления?
5. Изобразите на плоскости P,T диаграмму состояния однокомпонентного вещества. Какие участки диаграммы называются: кривой плавления, испарения, возгонки? Где начинаются и заканчиваются эти кривые? Что такое тройная точка?
6. Какое состояние вещества называется метастабильным? Приведите примеры метастабильных состояний. С чем связано существование метастабильных состояний? Что такое переохлажденная жидкость? Какие факторы способствуют пребыванию жидкости в переохлажденном состоянии, можно ли получить перегретое твердое тело?
7. Как изменяется энтропия вещества при его плавлении? кристаллизации?
Литература:
1. Методическое указание.
2. А.Н. Матвеев. Молекулярная физика. -М., Высшая школа, 1981, §31, 47.
3. И.К.Кикоин, А.И.Кикоин. Молекулярная физика. -М.,Наука,1976,§129-131.
4. Р.В. Телеснин. Молекулярная физика. -М., Высшая школа, 1973, §121.
Лабораторная работа 12
|
|
|


