 |
Электрохимия. Электропроводность растворов электролитов. Удельная и эквивалентная электропроводности. Зависимость электропроводности от концентрации.
|
|
|
|
Электрохимия – раздел физической химии изучающая свойства систем, в которых присутствуют заряженные частицы - ионы.
Электролиты – вещества способные распадаться на ионы.
Сильные электролиты – диссоциируют полностью или близко к этому.
Слабые – диссоциируют незначительно.
Степень диссоциации – отношение числа распавшихся молекул на ионы к общему числу молекул растворенного вещества.
> 0.3 – сильные. 0.03 < < 0.3 –средние. < 0.03 – слабые.
Растворы электролитов показывают большие отклонения от идеальности это связано с тем – что сильные электростатические поля связывают ионы и диполи растворимеля. Во -вторых диссоциация приводит к уменьшению концентрации растворителя.
Электропроводность – способность вещества проводить электричество.
Удельная электропроводность – проводимость кубика с ребром в 1 см помещенного между двумя электродами площадью 1 см2 каждый. Χ [Ом-1см-2]= 1/ρ.
Эквивалентная электропроводность – проводимость раствора содержащего 1 моль – эквивалент электролита заключенного между двумя электродами на расстоянии 1 см.
В последнем определении не указаны ни площадь электродов, ни объем раствора они могут быть любыми.
Λ[см /Ом* моль- экв]= χVэ, 16.1
Vэ – объем раствора содержащего 1 моль эквивалент растворенного вещества.
Λ= χ/Сэ,
Один моль эквивалент может содержаться в любом объеме растворителя. Малый объем соответствует большим значениям концентрации. Большой объем – маленькой концентрации. При больших концентрациях есть сильные электростатические взаимодействия между ионами и не полная диссоциация. Это приводит к снижению молярной и эквивалентной электропроводности. При увеличении объема электростатические взаимодействия ослабевают, и степень диссоциации растет. При предельном разбавлении степень диссоциации слабых электролитов такая же, как у сильных =1. Поэтому молярные электропроводности сильных и слабых электролитов имеют близкие значения.
|
|
|
Что касается удельной электропроводности то, мы всегда имеем дело с одним и тем же кубиком. Поэтому с ростом концентрации ионов проводимость сначала растет (так как растет число ионов), а затем уменьшается вследствие снижения и увеличения электростатических взаимодействий.


Удельная электропроводность растворов электролитов
Электрический ток есть упорядоченное перемещение заряженных частиц. Растворы электролитов обладают ионной проводимостью (являются т.н. проводниками второго рода), т.е. электропроводность растворов электролитов обусловлена перемещением ионов в электрическом поле (в отличие от электронной проводимости проводников первого рода).
Величина преимущественного передвижения иона в направлении одного из электродов при прохождении тока через раствор отнесённая к градиенту потенциала 1 В/см, есть абсолютная скорость движения иона. Абсолютные скорости движения ионов имеют величины порядка 0,0005 – 0,003 см2/(В·с). Абсолютные скорости движения катионов U+ и анионов U– различаются; это приводит к тому, что ионы разных знаков переносят разные количества электричества.
Всякий проводник, по которому течет ток, представляет для него определенное сопротивление R, которое, согласно закону Ома, прямо пропорционально длине проводника l и обратно пропорционально площади сечения S; коэффициентом пропорциональности является удельное сопротивление материала ρ – сопротивление проводника, имеющего длину 1 см и сечение 1 см2:
 , Ом (III.32)
, Ом (III.32)
В качестве количественной меры способности раствора электролита проводить электрический ток используют обычно удельную электропроводность κ (каппа) – величину, обратную удельному сопротивлению (т.е. величину, обратную сопротивлению столба раствора между электродами площадью 1 см2, находящимися на расстоянии 1 см):
|
|
|
 , Ом-1см-1 (III.33)
, Ом-1см-1 (III.33)
Величина удельной электропроводности электролита зависит от ряда факторов: природы электролита, температуры, концентрации раствора. Удельная электропроводность растворов электролитов (в отличие от электропроводности проводников первого рода) с увеличением температуры возрастает, что вызвано увеличением скорости движения ионов за счет понижения вязкости раствора и уменьшения сольватированности ионов. Зависимость удельной электропроводности от концентрации раствора представлена на рис. 3.7.

Рис. 3.7 Зависимость удельной электропроводности электролитов от концентрации
(1 – H2SO4, 2 – KOH, 3 – CH3COOH)
Как видно из рисунка, с увеличением концентрации удельная электропроводность растворов сначала возрастает, достигая некоторого максимального значения, затем начинает уменьшаться. Эта зависимость очень чётко выражена для сильных электролитов и значительно хуже для слабых. Наличие максимума на кривых объясняется тем, что в разбавленных растворах сильных электролитов скорость движения ионов мало зависит от концентрации, и κ сначала растет почти прямо пропорционально числу ионов; с ростом концентрации усиливается взаимодействие ионов, что уменьшает скорость их движения. Для слабых электролитов наличие максимума на кривой обусловлено тем, что с ростом концентрации уменьшается степень диссоциации, и при достижении определенной концентрации число ионов в растворе начинает увеличиваться медленнее, чем концентрация. Для учета влияния на электрическую проводимость растворов электролитов их концентрации и взаимодействия между ионами введено понятие молярной электропроводности раствора.
Молярная электропроводность растворов электролитов
Молярная электропроводность раствора λ есть величина, обратная сопротивлению раствора, содержащего 1 моль растворенного вещества и помещенного между электродами, расположенными на расстоянии 1 см друг от друга. С удельной электропроводностью κ и молярной концентрацией раствора С молярная электропроводность связана следующим соотношением:
|
|
|
 , Ом-1см2моль-1 (III.34)
, Ом-1см2моль-1 (III.34)
Молярная электропроводность как сильных, так и слабых электролитов увеличивается с уменьшением концентрации (т.е. увеличением разведения раствора V = 1/С), достигая некоторого предельного значения λo, называемого молярной электропроводностью при бесконечном разведении (рис. 3.8 – 3.9).

Рис. 3.8 Зависимость молярной Рис. 3.9 Зависимость молярной
электропроводности от концентрации. электропроводности от разведения
Для слабого электролита такая зависимость молярной электропроводности от концентрации обусловлена в основном увеличением степени диссоциации с разбавлением раствора. В случае сильного электролита с уменьшением концентрации ослабляется взаимодействие ионов между собой, что увеличивает скорость их движения и, следовательно, молярную электропроводность раствора. Последнюю связывает с абсолютными скоростями движения катионов и анионов U+ и U– уравнение Аррениуса (III.35):
 (III.35)
(III.35)
Ф. Кольрауш показал, что в молярную электропроводность бесконечно разбавленных растворов электролитов каждый из ионов вносит свой независимый вклад, и λo является суммой молярных электропроводностей катиона и аниона λ+ и λ– (т.н. подвижностей ионов), и сформулировал закон независимости движения ионов:
Молярная электропроводность при бесконечном разведении равна сумме электролитических подвижностей катиона и аниона данного электролита.
 (III.36)
(III.36)
Подставив в это выражение уравнение Аррениуса (III.35) и приняв, что при бесконечном разведении степень диссоциации α равна единице, получим:
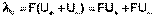 (III.37)
(III.37)
Отсюда
 ;
;  (III.38)
(III.38)
Электролитическая подвижность является важнейшей характеристикой иона, отражающей его участие в электропроводности раствора.
|
|
|


