 |
Гальванический элемент Электрохимический элемент. Уравнение Нернста. ЭДС. Термодинамика электрохимического элемента.
|
|
|
|
Электрохимический элемент – устройство, в котором возможно преобразовывать химическую энергию в электрическую и наоборот.
Он состоит из двух электродов опущенных в растворы электролитов. Сверху электроды соединяются проводом, электролиты соединяются между собой непосредственно (но разделены мембраной) или электрохимическим мостиком.
Электрод – метал погруженный в раствор, на который либо подается заряд, либо образуется.
Катод – отрицательный электрод. Катионы уходят в раствор, электроны остаются.
Анод – положительный заряд. Катионы на нем разряжаются.
Запись элемента Якоби –Даниэля.
(-)Zn│ZnSO4││CuSO4│Cu(+)
│- граница между фазами.
││- мостик.
Реакция в элементе:
Cu2+ + Zn2+ = Zn2+ + Cu2+
Электрохимический элемент работает обратимо, при постоянных Т, Р поэтому согласно второму началу термодинамике уменьшение свободной энергии равно максимальной полезной работе.
dG = -δWm полезн
W = zFE
E – потенциал в в/м,
F – постоянная Фарадея,
z – количество моль эквивалентов которое выделится или поглотится при прохождении zF количества электричества.
∆G = - zFE (1.18)
E = ∆G/zF – ЭДС –электродвижущая сила – разность потенциалов на полюсах обратимого электрохимического элемента.
ЭДС – считается положительной, если катионы и электроны движутся от катода к правому аноду.
Рассмотрим реакцию.
аА + вВ = сС + мМ
∆G T, P = RTlnПf/ - RTlnKf (2.18)
или
- zFE = RTlnПf/ - RTlnKf (3.18)
отсюда
E = (RT/zF)lnKf -(RT/zF) lnПf/ (4.18)
E0= (RT/zF)lnKf - стандартный электродный потенциал. (при Т = 2980К, Р = 1атм). В эту величину включаются все постоянные реакции активности и фугитивности веществ уходящих из области реакции в другую фазу.
Вспомним уравнение Гиббса-Гельмгольца.
|
|
|
∆G = ∆H + T (δ∆G/δT)P
Если подставить в него (1.18), то получится:
∆G = ∆H - T (δ zFE /δT)P. (5.18)
Или при необратимом тепловом эффекте ∆H = 0 так как реакция полностью обратима:
∆G = - zFT (dE /dT). (6.18)
С учетом ∆G = ∆H - T ∆S:
T ∆S = zFT (dE /dT). (7.18)
Если dE /dT больше нуля, то T ∆S тоже больше нуля тепловой эффект обратимой реакции положителен и система либо работает за счет притока тепла извне, либо с охлаждением. Если dE /dT меньше нуля, то T ∆S тоже меньше нуля и система выделяет тепло либо нагревается.
Тепловой эффект реакции:
∆H = ∆G + T ∆S = - zFE + zFT (dE /dT).
19. Электродный потенциал. Стандартный электродный потенциал. Типы электродов.
При переносе нейтрального вещества из одной фазы в другую совершается химическая работа, которая характеризуется изменением химического потенциала.
Перенос заряженных частиц из одной фазы в другую эквивалентен химической и электрической работе и определяется изменением электрохимического потенциала.
При переносе одного моля заряженных частиц из вакуума в фазу происходит следующее изменение электрохимического потенциала (Dm/i):
Dm/i = Dmi + zFg (1.19)
z – заряд иона.
F – число Фарадея.
g – вольта-потенциал – разность потенциалов между точками в вакууме и фазе.
При равновесии между двумя фазами будет:
Dma/i = Dmb/I (2.19)
Отсюда получается:
Dmai - DmbI = zFy (3.19)
y = gb - ga– гальвани-потенциал разность потенциалов между двумя точками в разных фазах. y > 0 если gb > ga.
Рассмотрим равновесие между электродом (восстановленная форма R) и его ионами в растворе (окисленная форма O).
O+ + l- = R0 (4.19)
Изменение электрохимических потенциалов для окисленного и восстановленного состояния будет:
Dm/(O+) = Dm(O+) + zFg0 = Dm0(O+) + RT ln ao + zFg0 (5.19)
Dm/(R0) = Dm(R0) + zFgR = Dm0(R0) + RT ln aR + zFgR (6.19)
Отсюда:
Dm0(O+) + RT ln ao + zFg0 = Dm0(R0) + RT ln aR + zFgR
Dm0(O+) - Dm0(R0) + RT ln ao/ aR = zFgR - zFg0
y = gR - g0 - потенциал переноса частиц из раствора в электрод.
y = y 0 + (RT/zF) ln ao/ aR (7.19)
|
|
|
y 0 = (Dm0(O+) - Dm0(R0))/ zF – стандартный электродный потенциал когда активности ao, aR равны единице.
Уравнение (7.19) справедливо и для условных электродных потенциалов.
Знак электрода определяется относительно водородного электрода, который берется условно за ноль. Записывается цепь, в которой слева водородный электрод справа определяемый.
Pt, H2ï2H+ úï Zn2+ï Zn (8.19)
Этой форме записи соответствует реакция восстановления цинка и окисления водорода.
Zn2+ + H2 = Zn + 2H+ (9.19)
На самом деле все наоборот, поэтому знак электрода Zn2+ï Zn отрицательный.
Чтобы знак полуэлемента отвечал знаку относительно стандартного водородного электрода необходимо, чтобы слева от черты был ион, который присутствует в растворе (не зависимо от того окисленная это или восстановленная форма).
- Cu2+ ï Cu, 2Cl- ï Cl2, Pt, Zn2+ï Zn +
Стандартный водородный электрод представляет собой платиновую пластинку покрытую платиновой чернью. Электрод омывается током водорода при Т = 2980К и давлением в одну атмосферу. Активности водорода и протона равны единице. 2H+ï H2, Pt.
Электродные потенциалы располагают относительно водородного электрода в ряд. С помощью водородной шкалы можно вычислить ЭДС цепи для этого необходимо из более положительного отнять более отрицательный электрод.
Виды электродов:
1. Электрод первого рода (двух фазный). – металл (или неметалл) погруженный в раствор, содержащий ионы этого вещества.
Se0 + 2l- = Se2- Se2- ï Se0
E = E0 + RT/zF ln a(Se0)/a(Se2-) = E0 - RT/zF ln a(Se2-)
2. Электрод второго рода (трех фазные) – состоит из металла покрытого слоем малорастворимой соли этого металла и находящийся в растворе соли, которая содержит тот же анион, что и соль покрывающая металл.
Cl- ï AgCl, Ag
E = E0 + RT/zF ln a(AgCl) a(Ag) / a(Cl-) = E0 - RT/zF ln a(Cl-)
3. Газовые электроды (трех фазные) – состоят из инертного металла омываемого током газа и раствора ионов этого газа.
1/2O2 + H2O + 2l- = 2OH- 2OH- ï1/2O2, H2O, Pt
E = E0 + RT/zF ln a(H2O) a1/2 (O2) / a2 (OH-).
4. Амальгамный электрод – состоит из амальгамы (сплав металла с ртутью, раствор металла в ртути) находящийся в равновесии с раствором, содержащим ионы этого металла.
Me+ + l- = Me(Hg) Me+ï Me, Hg
E = E0 + RT/zF ln a(Me+) / a (Me(Hg)).
5. Окислительно-востановительный электрод – инертный металл, погруженный в раствор, содержащий окисленную и восстановленную форму вещества.
|
|
|
MnO4- + 8H+ + 5l- = Mn2+ + 4H2O MnO4-, 8H+ ï Mn2+, Pt
E = E0 + RT/zF ln a (MnO4-) a8(H+) / a(Mn2+) a4(H2O).
Электрические потенциалы на фазовых границах
При соприкосновении проводника первого рода (электрода) с полярным растворителем (водой) либо раствором электролита на границе электрод – жидкость возникает т.н. двойной электрический слой (ДЭС). В качестве примера рассмотрим медный электрод, погруженный в воду либо в раствор сульфата меди.
При погружении медного электрода в воду часть ионов меди, находящихся в узлах кристаллической решетки, в результате взаимодействия с диполями воды будет переходить в раствор. Возникающий при этом на электроде отрицательный заряд будет удерживать перешедшие в раствор ионы в приэлектродном пространстве – образуется двойной электрический слой (рис. 3.10а; о моделях строения ДЭС смотрите п. 4.2.4). Отрицательный заряд на электроде будет препятствовать дальнейшему переходу ионов меди в раствор, и через некоторое время установится динамическое равновесие, которое можно однозначно охарактеризовать потенциалом электрического поля ДЭС Φ, зависящего от заряда на электроде, или некоторой равновесной концентрацией ионов в приэлектродном слое Сo. При погружении медного электрода в раствор СuSО4, содержащий ионы меди в концентрации С возможны три случая 
Рис. 3.10 Схема двойного электрического слоя на границе электрод-раствор
1. С < Сo. Поскольку концентрация ионов меди в поверхностном слое меньше равновесной, начнется переход ионов из электрода в раствор; электрод заряжается отрицательно, в поверхностном слое раствора катионов будет больше, чем анионов (рис. 3.9а).
2. С > Сo. Поскольку концентрация ионов меди в поверхностном слое больше равновесной, начнется переход ионов из раствора в электрод; на электроде возникает положительный заряд и в поверхностном слое преобладают анионы SО42- (рис. 3.9b).
3. С = Сo. Поскольку концентрация ионов меди в поверхностном слое равна равновесной (такие растворы называют нулевыми), заряд на электроде не возникает, двойной электрический слой не образуется.
|
|
|
18 Гальванический элемент. ЭДС гальванического элемента
Рассмотрим простейший гальванический элемент Даниэля-Якоби, состоящий из двух полуэлементов – цинковой и медной пластин, помещенных в растворы сульфатов цинка и меди соответственно, которые соединены между собой посредством электролитического ключа – например, полоски бумаги, смоченной раствором какого-либо электролита. Схематически данный элемент изображается следующим образом:
Zn / Zn2+ // Cu2+ / Cu
На поверхности каждого из электродов имеет место динамическое равновесие перехода ионов металла из электрода в раствор и обратно, характеризуемое потенциалом ДЭС (зарядом на электроде q). Если соединить медный и цинковый электроды металлическим проводником, немедленно произойдет перераспределение зарядов – электроны начнут перемещаться с электрода с более отрицательным зарядом (в нашем случае – цинкового) на электрод с более положительным зарядом (медный), т.е. в проводнике возникнет электрический ток. Изменение величины заряда каждого из электродов нарушает равновесие – на цинковом электроде начнется процесс перехода ионов из электрода в раствор (окисление металла), на медном – из раствора в электрод (восстановление металла); при этом протекание процесса на одном электроде обусловливает одновременное протекание противоположного процесса на другом:
Zno ––> Zn2+ + 2е-
Сu2+ + 2е- ––> Сuo
Электрод, на котором при работе гальванического элемента протекает процесс окисления, называется анодом, электрод, на котором идет процесс восстановления – катодом. При схематическом изображении гальванических элементов слева записывают анод, справа – катод (стандартный водородный электрод всегда записывают слева). Суммарный окислительно-восстановительный процесс, происходящий в гальваническом элементе, выражается следующим уравнением:
Сu2+ + Zno ––> Сuo + Zn2+
Т.о., гальванический элемент можно определить как прибор для преобразования химической энергии окислительно-восстановительной реакции в электрическую за счет пространственного разделения процессов окисления и восстановления. Работа, которую может совершить электрический ток, вырабатываемый гальваническим элементом, определяется разностью электрических потенциалов между электродами (называемой обычно просто разностью потенциалов) ΔΦ и количеством прошедшего по цепи электричества q:
 (III.39)
(III.39)
Работа тока гальванического элемента (и, следовательно, разность потенциалов), будет максимальна при его обратимой работе, когда процессы на электродах протекают бесконечно медленно и сила тока в цепи бесконечно мала. Максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента, есть электродвижущая сила (ЭДС) гальванического элемента.
|
|
|
19 Электродный потенциал. Уравнение Нернста
ЭДС гальванического элемента E удобно представлять в виде разности некоторых величин, характеризующих каждый из электродов – электродных потенциалов; однако для точного определения этих величин необходима точка отсчета – точно известный электродный потенциал какого-либо электрода. Электродным потенциалом электрода εэ называется ЭДС элемента, составленного из данного электрода и стандартного водородного электрода (см. ниже), электродный потенциал которого принят равным нулю. При этом знак электродного потенциала считают положительным, если в таком гальваническом элементе испытуемый электрод является катодом, и отрицательным, если испытуемый электрод является анодом. Необходимо отметить, что иногда электродный потенциал определяют как "разность потенциалов на границе электрод – раствор", т.е. считают его тождественным потенциалу ДЭС, что не вполне правильно (хотя эти величины взаимосвязаны).
Величина электродного потенциала металлического электрода зависит от температуры и активности (концентрации) иона металла в растворе, в который опущен электрод; математически эта зависимость выражается уравнением Нернста (здесь F – постоянная Фарадея, z – заряд иона):
 (III.40)
(III.40)
В уравнении Нернста ε° – стандартный электродный потенциал, равный потенциалу электрода при активности иона металла, равной 1 моль/л. Стандартные электродные потенциалы электродов в водных растворах составляют ряд напряжений. Величина ε° есть мера способности окисленной формы элемента или иона принимать электроны, т.е. восстанавливаться. Иногда различием между концентрацией и активностью иона в растворе пренебрегают, и в уравнении Нернста под знаком логарифма фигурирует концентрация ионов в растворе. Величина электродного потенциала определяет направление процесса, протекающего на электроде при работе гальванического элемента. На полуэлементе, электродный потенциал которого имеет большее (иногда говорят – более положительное) значение, будет протекать процесс восстановления, т.е. данный электрод будет являться катодом.
Рассмотрим расчёт ЭДС элемента Даниэля-Якоби с помощью уравнения Нернста. ЭДС всегда является положительной величиной и равна разности электродных потенциалов катода и анода:
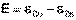 (III.41)
(III.41)
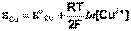 (III.42)
(III.42)
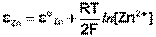 (III.43)
(III.43)
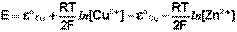 (III.44)
(III.44)
 (III.45)
(III.45)
Как видно из уравнения (III.45), ЭДС элемента Даниэля-Якоби зависит от концентрации (точнее говоря, активности) ионов меди и цинка; при их равных концентрациях ЭДС элемента будет равна разности стандартных электродных потенциалов:
 (III.46)
(III.46)
Анализируя уравнение (III.45), можно определить предел необратимой работы гальванического элемента. Поскольку на аноде идет процесс окисления цинка, концентрация ионов цинка при необратимой работе гальванического элемента постоянно увеличивается; концентрация ионов меди, напротив, уменьшается. Отношение концентраций ионов меди и цинка постоянно уменьшается и логарифм этого отношения при [Сu2+] < [Zn2+] становится отрицательным. Т.о., разность потенциалов при необратимой работе гальванического элемента непрерывно уменьшается; при E = 0 (т.е. εк = εа) гальванический элемент не может совершать работу (необратимая работа гальванического элемента может прекратиться также и в результате полного растворения цинкового анода).
Уравнение (III.45) объясняет также и работоспособность т.н. концентрационных цепей – гальванических элементов, состоящих из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными активностями а1 > а2. Катодом в этом случае будет являться электрод с большей концентрацией, т.к. стандартные электродные потенциалы обоих электродов равны; для ЭДС концентрационного гальванического элемента получаем:
 (III.47)
(III.47)
Единственным результатом работы концентрационного элемента является перенос ионов металла из более концентрированного раствора в менее концентрированный. Т.о., работа электрического тока в концентрационном гальваническом элементе – это работа диффузионного процесса, который проводится обратимо в результате пространственного разделения его на два противоположных по направлению обратимых электродных процесса.
20. Классификация электродов. Реакции, протекающие на электродах и соответствующий электродный потенциал.
Классификация электродов
По типу электродной реакции все электроды можно разделить на две группы (в отдельную группу выделяются окислительно-восстановительные электроды, которые будут рассмотрены особо в разделе 3.5.5).
Электроды первого рода
К электродам первого рода относятся электроды, состоящие из металлической пластинки, погруженной в раствор соли того же металла. При обратимой работе элемента, в который включен электрод, на металлической пластинке идет процесс перехода катионов из металла в раствор либо из раствора в металл. Т.о., электроды первого рода обратимы по катиону и их потенциал связан уравнением Нернста (III.40) с концентрацией катиона (к электродам первого рода относят также и водородный электрод).
 (III.40)
(III.40)
Электроды второго рода
Электродами второго рода являются электроды, в которых металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона и зависимость их электродного потенциала от температуры и концентрации аниона может быть записана в следующем виде:
 (III.48)
(III.48)
Электроды сравнения
Для определения электродного потенциала элемента необходимо измерить ЭДС гальванического элемента, составленного из испытуемого электрода и электрода с точно известным потенциалом – электрода сравнения. В качестве примеров рассмотрим водородный, каломельный и хлорсеребряный электроды.
Водородный электрод представляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода. Адсорбируемый платиной водород находится в равновесии с газообразным водородом; схематически электрод изображают следующим образом:
Рt, Н2 / Н+
Электрохимическое равновесие на электроде можно рассматривать в следующем виде:
2Н+ + 2е- ––> Н2
Потенциал водородного электрода зависит от активности ионов Н+ в растворе и давления водорода; потенциал стандартного водородного электрода (с активностью ионов Н+ 1 моль/л и давлением водорода 101.3 кПа) принят равным нулю. Поэтому для электродного потенциала нестандартного водородного электрода можно записать:
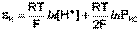 (III.49)
(III.49)
Каломельный электрод. Работа с водородным электродом довольно неудобна, поэтому в качестве электрода сравнения часто используется более простой в обращении каломельный электрод, величина электродного потенциала которого относительно стандартного водородного электрода точно известна и зависит только от температуры. Каломельный электрод состоит из ртутного электрода, помещенного в раствор КСl определенной концентрации и насыщенный каломелью Hg2Сl2:
Нg / Нg2Сl2, КСl
Каломельный электрод обратим относительно анионов хлора и уравнение Нернста для него имеет вид:
 (III.50)
(III.50)
Хлорсеребряный электрод. В качестве электрода сравнения используют также другой электрод второго рода – хлорсеребряный, представляющий собой серебряную проволоку, покрытую хлоридом серебра и помещённую в раствор хлорида калия. Хлорсеребряный электрод также обратим относительно анионов хлора:
Аg / АgСl, КСl
Величина потенциала хлорсеребряного электрода зависит от активности ионов хлора; данная зависимость имеет следующий вид:
 (III.51)
(III.51)
Чаще всего в качестве электрода сравнения используется насыщенный хлорсеребряный электрод, потенциал которого зависит только от температуры. В отличие от каломельного, он устойчив при повышенных температурах и применим как в водных, так и во многих неводных средах.
Индикаторные электроды.
Электроды, обратимые относительно иона водорода, используются на практике для определения активности этих ионов в растворе (и, следовательно, рН раствора) потенциометрическим методом, основанном на определении потенциала электрода в растворе с неизвестным рН и последующим расчетом рН по уравнению Нернста. В качестве индикаторного электрода может использоваться и водородный электрод, однако работа с ним неудобна и на практике чаще применяются хингидронный и стеклянный электроды.
Хингидронный электрод, относящийся к классу окислительно-восстановительных электродов (см. ниже), представляет собой платиновую проволоку, опущенную в сосуд с исследуемым раствором, в который предварительно помещают избыточное количество хингидрона С6Н4О2·С6Н4(ОН)2 – соединения хинона С6Н4О2 и гидрохинона С6Н4(ОН)2, способных к взаимопревращению в равновесном окислительно-восстановительном процессе, в котором участвуют ионы водорода:
С6Н4О2 + 2Н+ + 2е- ––> С6Н4(ОН)2
Хингидронный электрод является т.н. окислительно-восстановительным электродом (см. разд. 3.5.5); зависимость его потенциала от активности ионов водорода имеет следующий вид:
 (III.52)
(III.52)
Стеклянный электрод, являющийся наиболее распространенным индикаторным электродом, относится к т.н. ионоселективным или мембранным электродам. В основе работы таких электродов лежат ионообменные реакции, протекающие на границах мембран с растворами электролитов; ионоселективные электроды могут быть обратимы как по катиону, так и по аниону.
Принцип действия мембранного электрода заключается в следующем. Мембрана, селективная по отношению к некоторому иону (т.е. способная обмениваться этим ионом с раствором), разделяет два раствора с различной активностью этого иона. Разность потенциалов, устанавливающаяся между двумя сторонами мембраны, измеряется с помощью двух электродов. При соответствующем составе и строении мембраны её потенциал зависит только от активности иона, по отношению к которому мембрана селективна, по обе стороны мембраны.
Наиболее часто употребляется стеклянный электрод в виде трубки, оканчивающейся тонкостенным стеклянным шариком. Шарик заполняется раствором НСl с определенной активностью ионов водорода; в раствор погружен вспомогательный электрод (обычно хлорсеребряный). Потенциал стеклянного электрода с водородной функцией (т.е. обратимого по отношению к иону Н+) выражается уравнением
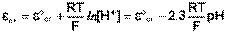 (III.53)
(III.53)
Необходимо отметить, что стандартный потенциал ε°ст для каждого электрода имеет свою величину, которая со временем изменяется; поэтому стеклянный электрод перед каждым измерением рН калибруется по стандартным буферным растворам с точно известным рН.
Окислительно-восстановительные электроды
В отличие от описанных электродных процессов в случае окислительно-восстановительных электродов процессы получения и отдачи электронов атомами или ионами происходят не на поверхности электрода, а только в растворе электролита. Если опустить платиновый (или другой инертный) электрод в раствор, содержащий двух- и трехзарядные ионы железа и соединить этот электрод проводником с другим электродом, то возможно либо восстановление ионов Fe3+ до Fe2+ за счет электронов, полученных от платины, либо окисление ионов Fe2+ до Fe3+ с передачей электронов платине. Сама платина в электродном процессе не участвуют, являясь лишь переносчиком электронов. Такой электрод, состоящий из инертного проводника первого рода, помещенного в раствор электролита, содержащего один элемент в различных степенях окисления, называется окислительно-восстановительным или редокс-электродом. Потенциал окислительно-восстановительного электрода также определяют относительно стандартного водородного электрода:
Pt, H2 / 2H+ // Fe3+, Fe2+ / Pt
Зависимость потенциала редокс-электрода εRO от концентрации (активности) окисленной [Ox] и восстановленной форм [Red] для окислительно-восстановительной реакции, в которой не участвуют никакие другие частицы, кроме окислителя и восстановителя, имеет следующий вид (здесь n – число электронов, участвующих в элементарном акте окислительно-восстановительной реакции):
 (III.54)
(III.54)
Из данного выражения следует уравнение для потенциала металлического электрода (III.40), т.к. активность атомов металла (восстановленной формы) в материале электрода равна единице.
В случае более сложных систем в выражении для окислительно-восстановительного потенциала фигурируют концентрации всех участвующих в реакции соединений, т.е. под окисленной формой следует понимать все соединения в левой части уравнения реакции
Ох + ne- ––> Red,
а под восстановленной – все соединения в правой части уравнения. Так, для окислительно-восстановительных реакций, протекающих с участием ионов водорода
Ох + ne- + mH+ ––> Red,
уравнение Нернста будет записываться следующим образом:
 (III.55)
(III.55)
При составлении гальванических элементов с участием редокс-электрода электродная реакции на последнем в зависимости от природы второго электрода может быть либо окислительной, либо восстановительной. Например, если составить гальванический элемент из электрода Pt / Fe3+, Fe2+ и второго электрода, имеющего более положительный электродный потенциал, то при работе элемента редокс-электрод будет являться анодом, т.е. на нем будет протекать процесс окисления:
Fe2+ ––> Fe3+ + e-
Если потенциал второго электрода будет меньше, чем потенциал электрода Pt / Fe3+, Fe2+, то на последнем будет протекать реакция восстановления и он будет являться катодом:
Fe3+ + e- ––> Fe2+
Знание величин электродных потенциалов позволяет определить возможность и направление самопроизвольного протекания любой окислительно-восстановительной реакции при одновременном наличии в растворе двух или более окислительно-восстановительных пар. Восстановленная форма любого элемента или иона будет восстанавливать окисленную форму другого элемента или иона, имеющего более положительный электродный потенциал.
Любая цепь состоит из двух электродов (больше включить в схему можно, но ни кто так не делает).
Для того чтобы в цепи был ток необходимо что бы разность потенциалов электродов цепи была не равна нуль ∆Е = Е2 –Е1 ≠ 0. Это уравнение может дать положительное и отрицательное значение в зависимость от того будем мы отнимать от более положительного электрода менее положительный или наоборот, но это ни как не скажется на явлении и на то какой из электродов будет анодом.
Для того чтобы ∆Е ≠ 0 необходимо чтобы хотя бы одна из величин в уравнениях Нернста для первого и второго электрода были не равны друг другу.
E = E0 + RT/zF ln ao/ aR (1.20)
Посмотрим на уравнение (1.20) R, z, F – меняться не могут. Все остальное может.
Если меняется E0 – это означает, что мы берем электроды разной природы. (Получаются химические цепи). При этом мы можем поместить каждый электрод в свой электролит или в один общий.
Если нет равенства между активностями хотя бы одного из компонентов участвующих в реакции в двух разных электродах, то получаются концентрационные цепи. Концентрационные цепи могут быть с переносом – вещество переносится от одного электрода к другому и без переноса тогда электроды погружены в собственные растворы и между ними нет прямого контакта.
Мы можем один электрод запихать в холодильник, а другой в печку и в этом случае у нас возникнет разность потенциалов.
Для того чтобы правильно написать цепь необходимо взять в руки справочник, найти нужные электроды, более положительный электрод – анод записать справа (на нем будет происходить восстановление), более отрицательный – катод слева (на нем вещество будет окисляться).
В схеме необходимо также указать, как соединены растворы электродов. Они могут быть в одном растворителе тогда указываются только границы фаз тв – ж, растворы могут быть разделены мембраной – тогда указывается вертикальная пунктирная прямая. Соединение может быть с помощью электрохимического ключа тогда - ïï.
|
|
|


