 |
Термодинамика
|
|
|
|
Термодинамика – это наука об общих тепловых свойствах термодинамических систем.
Число степеней свободы 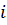 – этоколичество независимых координат, которые полностью определяют положение материальных точек в пространстве. Материальная точка в трёхмерном пространстве имеет три поступательные степени свободы
– этоколичество независимых координат, которые полностью определяют положение материальных точек в пространстве. Материальная точка в трёхмерном пространстве имеет три поступательные степени свободы  , а наличие осей вращения добавляет ещё вращательные степени свободы
, а наличие осей вращения добавляет ещё вращательные степени свободы  . В случае, если материальная точка может совершать колебательное движение, то добавляются ещё колебательные степени свободы
. В случае, если материальная точка может совершать колебательное движение, то добавляются ещё колебательные степени свободы  , причём число колебательных степеней свободы удваивается, так как в колебательном движении непрерывно происходит превращение кинетической энергии в потенциальную, и наоборот. Суммарное число степеней свободы определяется соотношением:
, причём число колебательных степеней свободы удваивается, так как в колебательном движении непрерывно происходит превращение кинетической энергии в потенциальную, и наоборот. Суммарное число степеней свободы определяется соотношением:  .
.
Число степеней свободы молекулы газа 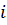 – это количество возможных независимых направлений движения молекулы. Для молекул одноатомного газа число степеней свободы
– это количество возможных независимых направлений движения молекулы. Для молекул одноатомного газа число степеней свободы 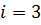 . Газ, каждая молекула которого состоит из двух атомов, называется двухатомным. Каждый атом двухатомного газа может двигаться по трём направлениям, поэтому общее число возможных направлений движения 6, но за счёт связи между молекулами число степеней свободы уменьшается на одну, поэтому число степеней свободы для молекул двухатомного газа
. Газ, каждая молекула которого состоит из двух атомов, называется двухатомным. Каждый атом двухатомного газа может двигаться по трём направлениям, поэтому общее число возможных направлений движения 6, но за счёт связи между молекулами число степеней свободы уменьшается на одну, поэтому число степеней свободы для молекул двухатомного газа  . Число степеней свободы для молекул многоатомного газа
. Число степеней свободы для молекул многоатомного газа  .
.
Термодинамическая система – это макроскопическое тело или совокупность макроскопических тел, которые взаимодействуют и обмениваются энергией, как между собой, так и между другими телами и/или с внешней средой.
Тепловое (термодинамическое) равновесие – это состояние термодинамической системы, при котором все её макроскопические параметры постоянны, а значит, объём и давление системы остаются неизменными, все тела (части) системы имеют равную температуру (не происходит теплообмен), отсутствуют переходы из одного агрегатного состояния в другое. При постоянных внешних условиях любая термодинамическая система самопроизвольно переходит в состояние теплового равновесия с течением времени.
|
|
|
Постулат Больцмана ( закон равнораспределения кинетической энергии по степеням свободы) : е сли система молекул находится в состоянии термодинамического равновесия при температуре  , то средняя кинетическая энергия равномерно распределена между всеми степенями свободы
, то средняя кинетическая энергия равномерно распределена между всеми степенями свободы 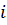 , причём на каждую степень свободы приходится энергия
, причём на каждую степень свободы приходится энергия  , а значит, средняя кинетическая энергия молекулы определяется соотношением:
, а значит, средняя кинетическая энергия молекулы определяется соотношением:  .
.
Внутренняя энергия тела  – это сумма кинетических энергий всех молекул этого тела и потенциальной энергии их взаимодействия.
– это сумма кинетических энергий всех молекул этого тела и потенциальной энергии их взаимодействия.
Внутренняя энергия идеального газа  – это сумма кинетических энергий всех молекул этого газа, так как в идеальном газе потенциальная энергия взаимодействия молекул равна нулю. Для состоящего из
– это сумма кинетических энергий всех молекул этого газа, так как в идеальном газе потенциальная энергия взаимодействия молекул равна нулю. Для состоящего из  молекул идеального газа его внутренняя энергия определяется соотношениями:
молекул идеального газа его внутренняя энергия определяется соотношениями:  .
.
Согласно уравнению Менделеева-Клапейрона, выражение для внутренней энергии идеального газа определяется соотношением:  .
.
Изменение внутренней энергии идеального газа  – это величина, которая характеризует различные состояния термодинамической системы при совершении работы над ней внешними силами (изменении потенциальной энергии молекул) и/или теплопередаче (изменении кинетической энергии молекул). Изменение внутренней энергии зависит только от начального и конечного состояния термодинамической системы и не зависит от способа, которым осуществляется этот переход. Изменение внутренней энергии постоянной массы
– это величина, которая характеризует различные состояния термодинамической системы при совершении работы над ней внешними силами (изменении потенциальной энергии молекул) и/или теплопередаче (изменении кинетической энергии молекул). Изменение внутренней энергии зависит только от начального и конечного состояния термодинамической системы и не зависит от способа, которым осуществляется этот переход. Изменение внутренней энергии постоянной массы  идеального газа с молярной массой
идеального газа с молярной массой  при изменении его температуры на величину
при изменении его температуры на величину  определяется соотношением:
определяется соотношением:  .
.
|
|
|
Работа идеального газа  – это работа, которую совершает идеальный газ вследствие изменения его объёма от величины
– это работа, которую совершает идеальный газ вследствие изменения его объёма от величины  до величины
до величины 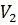 . Работа идеального газа характеризует процесс изменения внутренней энергии термодинамической системы и определяется соотношением:
. Работа идеального газа характеризует процесс изменения внутренней энергии термодинамической системы и определяется соотношением:  .
.
Работа внешних сил 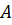 противоположна работе идеального газа
противоположна работе идеального газа  :
:  .
.
Количество теплоты  – это физическая величина, которая показывает, на какую величину изменяется внутренняя энергия термодинамической системы в процессе теплопередачи. Количество теплоты характеризует процесс передачи внутренней энергии от одних тел к другим, который не сопровождается превращениями энергии.
– это физическая величина, которая показывает, на какую величину изменяется внутренняя энергия термодинамической системы в процессе теплопередачи. Количество теплоты характеризует процесс передачи внутренней энергии от одних тел к другим, который не сопровождается превращениями энергии.
Теплоёмкость тела  – это физическая величина, определяющая количество теплоты, необходимое для увеличения температуры тела на 1 К. Теплоёмкость тела измеряется в джоуль на кельвин (Дж/К), а необходимое количество теплоты
– это физическая величина, определяющая количество теплоты, необходимое для увеличения температуры тела на 1 К. Теплоёмкость тела измеряется в джоуль на кельвин (Дж/К), а необходимое количество теплоты  для увеличения температуры тела на величину
для увеличения температуры тела на величину  определяется соотношением:
определяется соотношением:  .
.
Удельная теплоёмкость тела  – это физическая величина, определяющая количество теплоты, необходимое для нагревания тела массой 1 кг на 1 К. Удельная теплоёмкость тела измеряется в джоуль на килограмм на кельвин (Дж/(кг∙ К)), а необходимое количество теплоты
– это физическая величина, определяющая количество теплоты, необходимое для нагревания тела массой 1 кг на 1 К. Удельная теплоёмкость тела измеряется в джоуль на килограмм на кельвин (Дж/(кг∙ К)), а необходимое количество теплоты  для увеличения температуры тела массой
для увеличения температуры тела массой  на величину
на величину  определяется соотношением:
определяется соотношением:  .
.
Молярная теплоёмкость тела 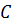 – это физическая величина, определяющая количество теплоты, необходимое для нагревания 1 моль вещества на 1 К. Молярная теплоёмкость тела измеряется в джоуль на моль на кельвин (Дж/(моль∙ К)), а необходимое количество теплоты
– это физическая величина, определяющая количество теплоты, необходимое для нагревания 1 моль вещества на 1 К. Молярная теплоёмкость тела измеряется в джоуль на моль на кельвин (Дж/(моль∙ К)), а необходимое количество теплоты  для увеличения температуры количества вещества
для увеличения температуры количества вещества  на величину
на величину  определяется соотношением:
определяется соотношением: 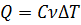 .
.
Агрегатные состояния вещества – это состояния одного и того же вещества при различных температурах и давлениях. Возможен переход их одного агрегатного состояния вещества в другое при изменении условий (температуры, давления). Переход твёрдого тела в жидкость называется плавлением, а обратный процесс – это кристаллизация. Переход жидкости в газ называется парообразованием, а обратный процесс – это конденсация. Переход твёрдого тела в газ называется сублимацией, а обратный процесс – это десублимация.
|
|
|
Удельная теплота плавления λ – это физическая величина, определяющая количество теплоты, которое необходимо передать твёрдому телу массой 1 кг, находящемуся при температуре плавления, чтобы полностью перевести его в жидкое состояние. Удельная теплота плавления измеряется в джоуль на килограмм (Дж/кг), а необходимое количество теплоты  для плавления твёрдого тела массой
для плавления твёрдого тела массой  определяется соотношением:
определяется соотношением:  .
.
Удельная теплота кристаллизации – это физическая величина, определяющая количество теплоты, которое выделится при кристаллизации 1 кг жидкости. Температура кристаллизации равна температуре плавления, удельная теплота кристаллизации равна удельной теплоте плавления, а количество теплоты  , выделяемое при кристаллизации жидкости массой
, выделяемое при кристаллизации жидкости массой  , считается отрицательным и определяется соотношением:
, считается отрицательным и определяется соотношением: 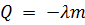 .
.
Удельная теплота парообразования r – это физическая величина, определяющая количество теплоты, которое необходимо передать жидкости массой 1 кг, находящейся при температуре кипения, чтобы перевести её в парообразное состояние. Удельная теплота парообразования измеряется в джоуль на килограмм (Дж/кг), а необходимое количество теплоты  для превращения жидкости массой
для превращения жидкости массой  в пар определяется соотношением:
в пар определяется соотношением: 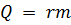 .
.
Удельная теплота конденсации – это физическая величина, определяющая количество теплоты, которое выделится при конденсации 1 кг пара. Температура конденсации равна температуре парообразования, удельная теплота конденсации равна удельной теплоте парообразования, а количество теплоты  , выделяемое при конденсации пара массой
, выделяемое при конденсации пара массой  , считается отрицательным и определяется соотношением:
, считается отрицательным и определяется соотношением:  .
.
Первое начало (первый закон) термодинамики – это закон сохранения и превращения энергии для термодинамической системы. Согласно первому началу термодинамики, работа может совершаться только за счёт теплоты или какой-либо другой формы энергии. При любых процессах, происходящих в изолированной системе, её внутренняя энергия остаётся постоянной, а значит, изменение внутренней энергии системы  при переходе её из одного состояния в другое равно сумме работы внешних сил
при переходе её из одного состояния в другое равно сумме работы внешних сил 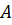 и количества теплоты, переданного системе
и количества теплоты, переданного системе  :
: 
|
|
|
Первое начало (первый закон) термодинамики: количество теплоты, полученное термодинамической системой, идет на изменение её внутренней энергии и на совершение работы против внешних сил:  .
.
Адиабатный процесс – это процесс, происходящий без теплообмена термодинамической системы с окружающей средой или другими системами. Для постоянной массы  идеального газа с молярной массой
идеального газа с молярной массой 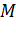 при переходе газа из одного состояния в другое при
при переходе газа из одного состояния в другое при  давление и объём связаны между собой уравнением адиабаты (уравнение Пуассона):
давление и объём связаны между собой уравнением адиабаты (уравнение Пуассона):  .
.
Коэффициент Пуассона  – это показатель адиабаты, который для идеального газа с числом степеней свободы молекул газа
– это показатель адиабаты, который для идеального газа с числом степеней свободы молекул газа  определяется соотношением:
определяется соотношением: 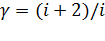 .
.
Адиабата – это графическое изображение адиабатного процесса на -диаграмме. Уравнение адиабаты – это уравнение кривой, такое, что при переходе идеального газа из состояния с макроскопическими параметрами  в состояние с макроскопическими параметрами
в состояние с макроскопическими параметрами  выполняется соотношение:
выполняется соотношение: 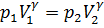 .
.
Второе начало (второй закон) термодинамики – это один из основных законов термодинамики, устанавливающий направленность процессов в природе и необратимость реальных термодинамических процессов.
Необратимый физический процесс – это процесс, который может самопроизвольно протекать только в одном определённом направлении. В обратном направлении такие процессы могут протекать только как одно из звеньев более сложного процесса.
Второе начало термодинамики в формулировке Клаузиуса: невозможно перевести теплоту от более холодной системы к более горячей при отсутствии других одновременных изменений в обеих системах или окружающих телах. Это означает, что теплота не может самопроизвольно переходить от более холодного тела к более горячему (принцип Клаузиуса).
Второе начало термодинамики в формулировке Кельвина: невозможны такие процессы, единственным конечным результатом которых явилось бы отнятие от некоторого тела определенного количества теплоты и полное его превращение в механическую работу.
Термодинамический цикл – это круговой процесс в термодинамике, то есть такой процесс, в котором совпадают начальные и конечные макроскопические параметры, определяющие состояние системы (давление, объём, температура), а значит, в котором периодически восстанавливается исходное состояние системы. В циклическом процессе внутренняя энергия не изменяется. Термодинамические циклы изображаются на -диаграмме с помощью замкнутых кривых, а направление цикла обозначается стрелками. Полная работа тела за цикл на -диаграмме равна площади внутри кривой цикла, причём работа положительна, если цикл обходится по часовой стрелке, и отрицательна, если цикл обходится в против часовой стрелки.
|
|
|
Тепловой двигатель (тепловая машина) – это устройство, способное превращать полученное количество теплоты в механическую работу. Механическая работа в тепловых двигателях производится в процессе расширения некоторого вещества, которое называется рабочим телом (пары бензина, воздух, водяной пар). Рабочее тело получает (или отдаёт) тепловую энергию в процессе теплообмена с телами, имеющими большой запас внутренней энергии (тепловыми резервуарами). Тепловой резервуар с более высокой температурой называют нагревателем, а тепловой резервуар с более низкой температурой называют холодильником. Процесс теплопередачи и преобразования полученного количества теплоты в работу в тепловом двигателе периодически повторяется, так как рабочее тело совершает термодинамический цикл. Совершая цикл, рабочее тело получает от нагревателя количество теплоты 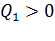 и отдаёт холодильнику количество теплоты
и отдаёт холодильнику количество теплоты  .
.
Полное количество теплоты  , потраченное рабочим телом за цикл, определяется соотношением:
, потраченное рабочим телом за цикл, определяется соотношением: 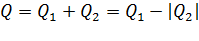 .
.
Полезная механическая работа  , совершаемая рабочим телом за цикл, равна потраченному за цикл количеству теплоты
, совершаемая рабочим телом за цикл, равна потраченному за цикл количеству теплоты  и определяется соотношением:
и определяется соотношением:  .
.
Коэффициент полезного действия (КПД)  теплового двигателя – это физическая величина, показывающая какая часть тепловой энергии, полученной рабочим телом от нагревателя, превратилась в полезную работу. КПД теплового двигателя измеряется в процентах (может быть выражен в долях) и определяется соотношением:
теплового двигателя – это физическая величина, показывающая какая часть тепловой энергии, полученной рабочим телом от нагревателя, превратилась в полезную работу. КПД теплового двигателя измеряется в процентах (может быть выражен в долях) и определяется соотношением:  .
.
Цикл Карно – это обратимый круговой процесс, состоящий из двух адиабатных и двух изотермических процессов и происходящий с идеальным газом. В цикле Карно последовательно происходят процессы: изотермическое расширение, адиабатное расширение, изотермическое сжатие и адиабатное сжатие. В цикле Карно термодинамическая система выполняет механическую работу и обменивается количество теплоты с двумя тепловыми резервуарами, имеющими постоянные, но различающиеся температуры. Тепловая машина, работающая по циклу Карно, преобразует количество теплоты в работу с максимально возможным коэффициентом полезного действия. КПД цикла Карно через температуры нагревателя  и холодильника
и холодильника  определяется соотношением:
определяется соотношением:  .
.
Теорема Карно: максимальный КПД любой тепловой машины не может превосходить КПД тепловой машины Карно, работающей при тех же температурах нагревателя и холодильника. В этой связи, тепловую машину, работающую по циклу Карно, часто называют идеальной тепловой машиной.
|
|
|


