 |
Молекулярная физика
|
|
|
|
Молекулярная физика – это раздел физики, который изучает физические свойства тел на основе рассмотрения их молекулярного строения. Задачи молекулярной физики связаны с изучением движения и взаимодействия частиц (атомов, молекул, ионов), составляющих физические тела. Основой молекулярной физики является молекулярно-кинетическая теория.
Молекулярно-кинетическая теория – это теория, объясняющая тепловые явления в макроскопических телах и свойства этих тел на основе их молекулярного строения.
Макроскопическая система – это система, которая состоит из огромного числа химически невзаимодействующих хаотично движущихся частиц, поведение которых подчиняется законам механики и статистики.
Тело – это макроскопическая система, заключённая в определённый объём. Молекулярное строение тел в рамках молекулярно-кинетической теории предполагает следующее: вещество любого тела состоит из частиц, которые разделены промежутками; все частицы хаотически движутся и механически взаимодействуют друг с другом; частицы каждого вещества имеют определённую массу.
Масса частицы очень мала для измерения в стандартных единицах массы, поэтому для измерения масс частиц вещества (атомов и молекул) в молекулярной физике принята особая единая система измерения, которая измеряет массы частиц вещества относительно массы нейтрального атома изотопа углерода 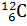 .
.
Масса нейтрального атома изотопа углерода 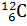
 – это физическая постоянная, которая измеряется в килограммах (кг):
– это физическая постоянная, которая измеряется в килограммах (кг):  .
.
Атомная единица массы – это единица измерения массы частиц вещества, которая равна 1/12 массы нейтрального атома изотопа углерода 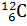 . Атомная единица массы обозначается а. е. м., причём
. Атомная единица массы обозначается а. е. м., причём 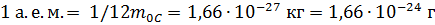 .
.
|
|
|
Относительная атомная масса элемента  – это безразмерная величина, равная отношению абсолютной массы атома какого-либо элемента к атомной единице массы. При расчете относительной атомной массы учитывается изотопный состав элемента. Величины
– это безразмерная величина, равная отношению абсолютной массы атома какого-либо элемента к атомной единице массы. При расчете относительной атомной массы учитывается изотопный состав элемента. Величины  элементов содержатся в таблице химических элементов Д. И. Менделеева.
элементов содержатся в таблице химических элементов Д. И. Менделеева.
Относительная молекулярная масса вещества  – это безразмерная величина, равная отношению абсолютной массы молекулы вещества
– это безразмерная величина, равная отношению абсолютной массы молекулы вещества  к атомной единице массы:
к атомной единице массы:  .
.
Относительная молекулярная масса равна сумме относительных атомных масс элементов, входящих в состав молекулы, и может быть определена по таблице химических элементов Д. И. Менделеева.
Постоянная Авогадро (число Авогадро)  – это физическая постоянная, которая численно равна количеству атомов в 12 г нейтрального атома изотопа углерода
– это физическая постоянная, которая численно равна количеству атомов в 12 г нейтрального атома изотопа углерода 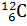 , а её единицей измерения является обратный моль (моль-1):
, а её единицей измерения является обратный моль (моль-1): 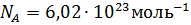 .
.
Моль – это одна из основных единиц измерения в физике, используемая для измерения количества вещества. Количество вещества в 1 моль содержит столько молекул, сколько содержится атомов в 12 г нейтрального атома изотопа углерода 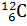 . Другими словами, 1 моль любого вещества содержит в себе число молекул вещества численно равное постоянной Авогадро.
. Другими словами, 1 моль любого вещества содержит в себе число молекул вещества численно равное постоянной Авогадро.
Количество вещества  – это отношение числа молекул
– это отношение числа молекул  в веществе к числу молекул в 1 моле вещества. Количество вещества измеряется в молях (моль) и определяется соотношением:
в веществе к числу молекул в 1 моле вещества. Количество вещества измеряется в молях (моль) и определяется соотношением:  .
.
Молярная масса вещества  – это масса 1 моль вещества. Так как 1 моль любого вещества содержит в себе число молекул вещества численно равное постоянной Авогадро, а каждая молекула имеет массу
– это масса 1 моль вещества. Так как 1 моль любого вещества содержит в себе число молекул вещества численно равное постоянной Авогадро, а каждая молекула имеет массу  , то молярная масса измеряется в килограммах на моль (кг/моль) и определяется соотношением:
, то молярная масса измеряется в килограммах на моль (кг/моль) и определяется соотношением:  .
.
Молярная и относительная молекулярная массы вещества связаны соотношением:  .
.
Молярная масса смеси веществ – это среднее арифметическое взвешенное молярной массы массовых долей входящих в смесь индивидуальных веществ.
|
|
|
Масса вещества  - это масса всех
- это масса всех  частиц вещества, каждая из которых имеет массу
частиц вещества, каждая из которых имеет массу  . Масса вещества определяется соотношением:
. Масса вещества определяется соотношением:  .
.
Количество вещества массой  определяется соотношением:
определяется соотношением:  .
.
Концентрация частиц  - это количество частиц в единице объёма. Концентрация измеряется в обратных кубических метрах (м-3) и определяется отношением общего количества частиц вещества
- это количество частиц в единице объёма. Концентрация измеряется в обратных кубических метрах (м-3) и определяется отношением общего количества частиц вещества  к объёму
к объёму 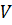 , в котором они находятся:
, в котором они находятся: 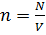 .
.
Идеальный газ – это математическая модель газа, молекулами которого являются материальные точки (абсолютно упругие твёрдые шарики бесконечно малого объёма), взаимодействия между которыми проявляются только при непосредственном столкновении их друг с другом или со стенками сосуда (молекулы газа не взаимодействуют между собой на расстоянии). Все молекулы идеального газа движутся хаотично, их движения подчиняются законам Ньютона, при соударениях они испытывают абсолютно упругие взаимодействия. Количество молекул идеального газа сравнимо с постоянной Авогадро даже в самых малых объёмах. Любой газ всегда занимает весь объём сосуда, в котором он находится.
Смесь идеальных газов – это идеальный газ, состоящий из нескольких идеальных газов, причём каждый из них равномерно распределен по всему объёму сосуда, занимаемому смесью газов. Каждый компонент смеси идеальных газов занимает объём, равный объёму сосуда, и все компоненты смеси находятся при одинаковой температуре.
Парциальное давление – это давление, которое оказывал бы данный газ, если бы он один занимал весь объём, а не являлся частью смеси газов.
Закон Дальтона определяет, что давление смеси  идеальных газов
идеальных газов  , которые друг с другом химически не взаимодействуют, равно сумме парциальных давлений газов этой смеси:
, которые друг с другом химически не взаимодействуют, равно сумме парциальных давлений газов этой смеси:  .
.
Закон Авогадро определяет, что п ри одинаковых давлениях и одинаковых температурах, в равных объёмах различных идеальных газов содержится одинаковое число молекул.
Распределение Максвелла – это теоретическая закономерность, которая показывает, что при данной температуре есть молекулы с очень высокими и очень малыми скоростями, но большая часть молекул движется с некоторой средней скоростью, которая называется наиболее вероятной скоростью теплового (хаотического) движения молекул.
|
|
|
Среднее значение квадрата наиболее вероятной скорости 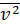 – это скорость, которая характеризует наиболее вероятную скорость теплового (хаотического) движения молекул идеального газа, так как скорость движения конкретной молекулы идеального газа невозможно точно определить.
– это скорость, которая характеризует наиболее вероятную скорость теплового (хаотического) движения молекул идеального газа, так как скорость движения конкретной молекулы идеального газа невозможно точно определить.
Среднеквадратичная скорость  – этонаиболее вероятная скорость движения молекул идеального газа, которая определяется соотношением:
– этонаиболее вероятная скорость движения молекул идеального газа, которая определяется соотношением: 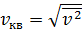 .
.
Средняя кинетическая энергия 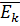 – этосредняя кинетическая энергия теплового движения молекул идеального газа, содержащихся в единице объёма, которая определяется соотношением:
– этосредняя кинетическая энергия теплового движения молекул идеального газа, содержащихся в единице объёма, которая определяется соотношением:  .
.
Основное уравнение молекулярно-кинетической теории – это уравнение, котороеустанавливает связь между макроскопическими параметрами состояния идеального газа (давление  , объём
, объём 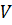 , температура
, температура  ) и его микроскопическими параметрами (концентрация частиц
) и его микроскопическими параметрами (концентрация частиц  , масса молекулы
, масса молекулы  , наиболее вероятная скорость движения молекул
, наиболее вероятная скорость движения молекул 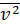 ) и определяется соотношениями:
) и определяется соотношениями:  или
или  .
.
Температура в энергетических единицах  – это физическая величина, которая измеряется в джоулях (Дж) и определяется соотношением:
– это физическая величина, которая измеряется в джоулях (Дж) и определяется соотношением: 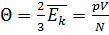 .
.
Температура – это одна из основных единиц измерения в физике, используемая для характеристики средней кинетической энергии движения всех молекул тела. Температура измеряется в кельвинах (К), и такая температура носит название абсолютной или термодинамической температуры.
Связь между абсолютной температурой в кельвинах  и температурой в градусах Цельсия
и температурой в градусах Цельсия  определяется соотношением:
определяется соотношением:  .
.
Постоянная Больцмана  – это физическая постоянная, определяющая связь между абсолютной температурой
– это физическая постоянная, определяющая связь между абсолютной температурой  и температурой в энергетических единицах
и температурой в энергетических единицах  . Постоянная Больцмана измеряется в джоулях на кельвин (Дж/К):
. Постоянная Больцмана измеряется в джоулях на кельвин (Дж/К):  .
.
Связь между абсолютной температурой  и температурой в энергетических единицах
и температурой в энергетических единицах  определяется соотношением:
определяется соотношением: 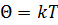 .
.
Средняя кинетическая энергия 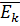 теплового движения молекул идеального газа пропорциональна абсолютной температуре и определяется соотношением:
теплового движения молекул идеального газа пропорциональна абсолютной температуре и определяется соотношением:  .
.
|
|
|
Основное уравнение молекулярно-кинетической теории тогда определяется соотношением: 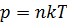 .
.
Нормальные условия – это набор постоянных внешних условий (температура  и давление
и давление 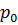 ):
):  ,
, 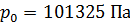 .
.
Молярный объём 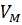 – это объём, который занимает 1 моль любого идеального газа при нормальных условиях. Молярный объём является физической постоянной и измеряется в кубических метрах (м3):
– это объём, который занимает 1 моль любого идеального газа при нормальных условиях. Молярный объём является физической постоянной и измеряется в кубических метрах (м3): 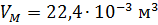 .
.
Универсальная газовая постоянная  – это физическая постоянная, численно равная работе 1 моль идеального газа при увеличении его температуры на 1 К (при условии неизменного давления). Универсальная газовая постоянная измеряется в джоуль на моль на кельвин (Дж/(моль∙ К)) и определяется соотношением:
– это физическая постоянная, численно равная работе 1 моль идеального газа при увеличении его температуры на 1 К (при условии неизменного давления). Универсальная газовая постоянная измеряется в джоуль на моль на кельвин (Дж/(моль∙ К)) и определяется соотношением:  .
.
Уравнение Менделеева-Клапейрона (уравнение состояния идеального газа) – это математическая зависимость между макроскопическими параметрами идеального газа (давлением  , объёмом
, объёмом 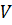 , температурой
, температурой  ), которые определяют его состояние. Уравнение Менделеева-Клапейрона определяется соотношением:
), которые определяют его состояние. Уравнение Менделеева-Клапейрона определяется соотношением: 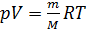 .
.
Процесс – это какое-либо изменение состояния макроскопической системы во времени.
Изопроцесс идеального газа – это процесс, протекающий с постоянной массой идеального газа при неизменном значении одного из его макроскопических параметров. Традиционно, изопроцессы графически изображаются как зависимость давления от объёма  (
(  -диаграмма), давления от температуры
-диаграмма), давления от температуры 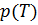 (
( 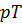 -диаграмма) и объёма от температуры
-диаграмма) и объёма от температуры  (
( 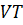 -диаграмма).
-диаграмма).
Объединенный газовый закон – это соотношение, которое устанавливает математическую зависимость макроскопических параметров идеального газа в изопроцессах. Объединенный газовый закон устанавливает, что для постоянной массы  идеального газа с молярной массой
идеального газа с молярной массой  при переходе газа из одного состояния в другое отношение его макроскопических параметров остаётся постоянным и определяется соотношением:
при переходе газа из одного состояния в другое отношение его макроскопических параметров остаётся постоянным и определяется соотношением:  .
.
Изотермический процесс – этопроцесс, который протекает при постоянной температуре и подчиняется закону Бойля-Мариотта: для постоянной массы  идеального газа с молярной массой
идеального газа с молярной массой  при переходе газа из одного состояния в другое при постоянной температуре произведение объёма газа на его давление остаётся постоянным:
при переходе газа из одного состояния в другое при постоянной температуре произведение объёма газа на его давление остаётся постоянным: 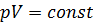 .
.
Изотерма – это графическое изображение изотермического процесса на -диаграмме. Уравнение изотермы – это уравнение равносторонней гиперболы, такое, что при переходе идеального газа из состояния с макроскопическими параметрами  в состояние с макроскопическими параметрами
в состояние с макроскопическими параметрами  выполняется соотношение:
выполняется соотношение: 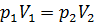 .
.
Изобарный процесс – этопроцесс, который протекает при постоянном давлении и подчиняется закону Гей-Люссака: для постоянной массы  идеального газа с молярной массой
идеального газа с молярной массой  при переходе газа из одного состояния в другое при постоянном давлении отношение объёма газа к его абсолютной температуре остаётся постоянным:
при переходе газа из одного состояния в другое при постоянном давлении отношение объёма газа к его абсолютной температуре остаётся постоянным: 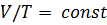 .
.
|
|
|
Изобара – это графическое изображение изобарного процесса на -диаграмме. Уравнение изобары – это уравнение прямой, проходящей через начало координат, такое, что при переходе идеального газа из состояния с макроскопическими параметрами  в состояние с макроскопическими параметрами
в состояние с макроскопическими параметрами 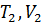 выполняется соотношение:
выполняется соотношение: 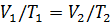 .
.
Изохорный процесс – этопроцесс, который протекает при постоянном объёме и подчиняется закону Шарля: для постоянной массы  идеального газа с молярной массой
идеального газа с молярной массой  при переходе газа из одного состояния в другое при постоянном объёме отношение давления газа к его абсолютной температуре остаётся постоянным:
при переходе газа из одного состояния в другое при постоянном объёме отношение давления газа к его абсолютной температуре остаётся постоянным: 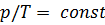 .
.
Изохора – это графическое изображение изохорного процесса на -диаграмме. Уравнение изохоры – это уравнение прямой, проходящей через начало координат, такое, что при переходе идеального газа из состояния с макроскопическими параметрами 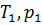 в состояние с макроскопическими параметрами
в состояние с макроскопическими параметрами  выполняется соотношение:
выполняется соотношение:  .
.
|
|
|


