 |
Внутриутробное развитие легких.
|
|
|
|
Эпидемиология.
РДС является наиболее частой причиной возникновения дыхательной недостаточности в раннем неонатальном периоде. Встречаемость его тем выше, чем меньше гестационный возраст и масса тела ребёнка при рождении. Однако на частоту встречаемости РДС сильно влияют методы пренатальной профилактики при угрозе преждевременных родов.
У детей, родившихся ранее 30 недель гестации и не получавших пренатальной профилактики стероидными гормонами, его частота составляет около 65%, при наличии пренатальной профилактики - 35%; у детей, родившихся на сроке гестации 30-34 недели без профилактики - 25%, при наличии профилактики - 10%.
У недоношенных детей, родившихся на сроке более 34 недель гестации, его частота не зависит от пренатальной профилактики и составляет менее 5%. (Володин Н.Н. и соавт. 2007)
Этиология.
· дефицит образования и выброса сурфактанта;
· качественный дефект сурфактанта;
· ингибирование и разрушение сурфактанта;
· незрелость структуры легочной ткани.
Факторы риска.
Факторами риска РДС являются все состояния, приводящие к дефициту сурфактанта и незрелости легких, а именно: асфиксия плода и новорожденного, морфо-функциональная незрелость, нарушение легочно-сердечной адаптации, легочная гипертензия, обменные нарушения (ацидоз, гипопротеинемия, гипоферментоз, изменения электролитного обмена) [8], не леченный сахарный диабет беременной, кровотечения у беременных, кесарево сечение, мужской пол новорожденного и рождение вторым из двойни.
Внутриутробное развитие легких.
Система трахеобронхиального дерева начинается как зачаток легкого, которое в последующем непрерывно делится и развивается, проникая в мезенхиму, и расширяется к периферии. Этот процесс проходит 5 фаз развития (рис.1):
|
|
|
1. Эмбриональная фаза (< 5 недели)
2. Псевдограндулярная фаза (5-16 недели)
3. Каналикулярная фаза (17-24 недели)
4. Фаза развития терминального мешка (24-37 недели)
5. Альвеолярная фаза (с конца 37 недели до 3 лет).
Зачаток респираторного тракта появляется у 24-дневного эмбриона, в последующие 3 дня формируются два первичных бронха. Первые хрящевые элементы в бронхах появляются на 10-й неделе, а на 16-й неделе практически заканчивается внутриутробное формирование всех генераций бронхиального дерева, хотя хрящи продолжают появляться до 24-й недели гестационного периода.
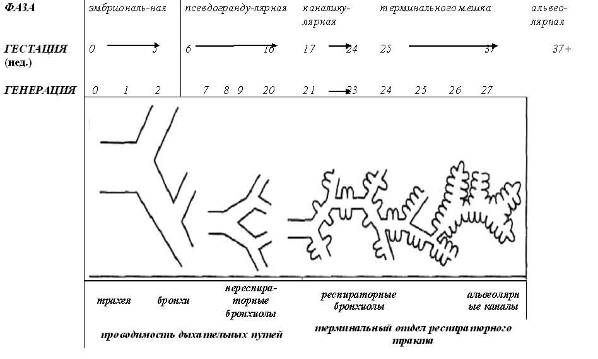
Рисунок 1. Пять фаз развития трахеобронхиальных дыхательных путей. ( adapted from Weibel ER: Morphomeiry of the Human Lung. Berlin, Springer-Verlag, 1963.)
Асимметрия главных бронхов отмечается унте с первых дней их развития; зачатки долевых бронхов различимы у зародыша 32 дней, а сегментарных - 36 дней. К 12-и неделе легочные доли уже различимы.
Дифференцировка легочной ткани начинается с 18-20-й педели, когда возникают альвеолы с капиллярами в стенках. В возрасте 20 нед обычно накапчивается и канализация бронхов, просвет которых выстилает кубический эпителий.
Альвеолы возникают как выросты на бронхиолах, причем с 28-й недели они увеличиваются в числе. Поскольку новые альвеолы могут формироваться в течение всего внутриутробного периода, в легких новорожденных можно обнаружить концевые воздушные пространства, выстланные кубическим эпителием.
Зачаток легкого кровоснабжается вначале через парные сегментарные артерии, отходящие от дорсальной части аорты. Сосудистые элементы легкого начинают формироваться из мезенхимы с 20-недельпого возраста как ветви этих артерий. Постепенно легочные капилляры теряют связь с сегментарными артериями, и их кровоснабжение обеспечивается ветвями легочной артерии, которые в целом следуют за ветвлением дыхательной трубки. Анастомозы между системой легочной и бронхиальной артерий сохраняются до рождения и у недоношенных детей первых недель жизни могут функционировать.
|
|
|
Уже у эмбриона 28-30 дней кровь из легких оттекает в левое предсердие, где формируется венозный синус.
На 26-28-й неделе внутриутробного периода капиллярная сеть легкого тесно смыкается с альвеолярной поверхностью; э этого момента легкое приобретает способность к газообмену.
Развитие артерий легкого сопровождается прогрессивным увеличением их просвета, который вначале не превышает нескольких микрометров. Просвет долевых артерий увеличивается лишь на 10-й неделе внутриутробного периода, а просвет терминальных и респираторных артериол - только на 36-38-й неделе. Относительное увеличение просвета артерий наблюдается в течение первого года жизни.
Лимфатические сосуды, окружающие бронхи, артерии и вены, к моменту рождения достигают альвеол; эта система закладывается у 60-дпевного вибриона.
Слизистые железы в трахее закладываются путем вторичной инвагинации эпителия на 7-8-й неделе, бокаловидные клетки - на 13-14-й неделе. На 26-й неделе внутриутробной жизни слизистые железы начинают выделять слизь, содержащую кислые гликозаминогликаны (мукополисахариды).
Реснички эпителия в трахее и главных бронхах возникают о 10-й, а в периферических бронхах - с 13-й недели. В бронхиолах наряду с клетками реснитчатого эпителия имеются цилиндрические клетки, содержащие в верхушечной части секреторные гранулы.
Наиболее периферический слой внутренней выстилки респираторного тракта представлен альвеолоцитами двух типов, появляющихся с 6-го месяца внутриутробного периода. Альвеолоциты I типа покрывают до 95% поверхности альвеол; остаток площади занимают альвеолоциты II типа, имеющие развитый пластинчатый комплекс (аппарат Гольджи), митохондрии и осмиофильные включения. Основная функция последних - продукция сурфактанта, который появляется у плодов массой 500-1200 г; дефицит сурфактанта тем выше, чем меньше гестационный возраст новорожденного. Сурфактант в первую очередь образуется в верхних долях, затем в нижних.
Другой функцией альвеолоцитов II типа является пролиферация и трансформация в альвеолоциты I типа при повреждении последних.
|
|
|
Сурфактант, продуцируемый альвеолоцитами II типа, основу которого составляют фосфолипиды (главным образом дипальмитоил фосфатидилхолин), выполняет важнейшую функцию - стабилизирует терминальные воздухсодержащие пространства. Образуя тонкую сплошную выстилку альвеол, сурфактант изменяет поверхностное натяжение в зависимости от радиуса альвеол. При увеличении радиуса альвеол на вдохе поверхностное натяжение возрастает до 40-50 дин/см, существенно повышая эластическое сопротивление дыханию. При низких объемах альвеол натяжение падает до 1-5 дин/см, что обеспечивает стабильность альвеол на выдохе. Дефицит сурфактанта у недоношенных детей является одной из ведущих причин РДС.
Синтез сурфактанта.
Сурфактант (Surfactant (англ.) - Surface Active Agent) - поверхностно-активное вещество, синтезируемое альвеолоцитами II типа (покрывающими около 3% поверхности альвеол) и безволосковыми бронхиолярными клетками (клетки Клара). Он на 90% состоит из липидов и 10 % сухого веса сурфактанта - белки. Липиды на 90 % состоят из фосфолипидов: фосфатидилхолин (лецитин) - 70 % (4 5 - 5 0 % - окисленный, насыщенный и 20 - 25 % - ненасыщенный), фосфатидилглицерол - 6% и другие фосфолипиды - 6 %; 10% - нейтральные липиды. Белки: протеины А, В, С, D.
Сурфактант обладает следующими основными функциями:
· препятствует спадению альвеол на выдохе;
· защищает альвеолярный эпителий от повреждений и способствует мукоцилиарному клиренсу;
· обладает бактерицидной активностью против грамположительных микробов и стимулирует макрофагальную реакцию в легких;
· участвует в регуляции микроциркуляции в легких и проницаемости стенок альвеол, препятствует развитию отека легких.
Важную роль в выполнении указанных функций сурфактанта играют белки, из которых A (SpA) и D (SpD) - гидрофильные - вовлекаются в защитные механизмы организма ребенка (не содержатся в сурфактантах легких животных), а протеины В (SpB) и С (SpC) - гидрофобные - снижают поверхностное натяжение альвеол за счет стимуляции абсорбции фосфолипидов на поверхности аэрогематического барьера и способствуют равномерному распределению сурфактанта на поверхности альвеол (содержатся в сурфактантах, полученных из легких животных). Гены, определяющие синтез сурфактантных белков SpA и SpD, находятся на 10-й хромосоме, a SpB - на 2-й и SpC - на 8-й. SpA появляется в околоплодной жидкости человека на 19-й неделе гестации, a SpB - на 31-й; в дальнейшем уровень их непрерывно нарастает.
|
|
|
При этом согласно современным представлениям, наиболее важным среди этих белков является сурфактантный протеин В, ибо его наследственный или врожденный дефицит является летальным для человека. Наследуется дефицит SpB по ayтосомно-рецессивному типу и проявляется у доношенных детей клиникой типичного РДС недоношенных с длительной потребностью в ИВЛ. Заместительная терапия животными сурфактантами оказывает лишь транзиторный эффект. Возможное лечение - трансплантация легких.
Синтез сурфактантных протеинов стимулируют глюкокортикоиды, тиреоидные гормоны, эстрогены, адреналин и норадреналин, тормозит - инсулин.
Сурфактант начинает вырабатываться у плода с 20 - 24-й недели внутриутробного развития альвеолярными клетками II типа. Он накапливается в них в виде осмиофильных гранул, мигрирующих на поверхности альвеол, где образует тонкую пленку в гипофазе. Особенно интенсивный сброс сурфактанта происходит в момент родов, что способствует процессу первичного расправления легких. Период полураспада сурфактанта - 10 - 20 ч.
Существуют два пути синтеза основного фосфолипидного компонента - фосфатидилхолина (лецитина):
1) метилирование фосфатидилэтаноламина (кефалина) при помощи метилтрансферазы (источник метильной группы метионин);
2) синтезирование из цитидиндифосфатхолина в присутствии фосфохолинтрансферазы, вступающего в реакцию с диглицеридом.
Установлено, что до 33-35-й недели внутриутробного развития синтез сурфактанта в основном осуществляется путем метилирования этаноламина, а позднее - при помощи фосфатидилхолинтрансферазы.
Первый путь синтеза сурфактанта легко истощается под влиянием гипоксии, ацидоза, гипотермии. Поэтому считают, что полностью система сурфактанта созревает к 35-36-й неделе внутриутробного развития.
У ребенка, родившегося до этого срока, имеющиеся запасы сурфактанта обеспечивают начало дыхания и формирования функциональной остаточной емкости легких, но из-за отставания синтеза сурфактанта от темпов его распада возникает недостаток этого вещества, что приводит к спадению альвеол на выдохе, резкому возрастанию работы дыхательных мышц, поскольку из-за неустановившейся функциональной остаточной емкости легких, повышенной их жесткости усилия, необходимые для каждого последующего раздувания легких, должны быть такими же, как и для первого дыхания. Кроме того, вследствие спадения альвеол, непрерывного газообмена в легких не происходит, что провоцирует развитие гипоксемии и гиперкапнии.
|
|
|
Уточним, что наряду с фосфатидилхолином (таблица 1) для нормального функционирования сурфактанта имеют значение и другие его компоненты, особенно фосфатидилглицерин и фосфатидилинозитол. Например, в смывах с легких детей, умерших от РДС, родившихся от матерей с сахарным диабетом количество лецитина и сфингомиелина и соотношения между ними нормальные, но имеется дефицит фосфатидилглщерина. С другой стороны, у глубоко недоношенного ребенка при низком уровне лецитина в околоплодных водах, но нормальном содержании фосфатидилглицерина РДС не развивается. При РДС, помимо исчезновения фосфатидилглицерина из сурфактанта, в нем снижено количество насыщенного фосфатидилхолина и увеличено содержание фосфатидилсерина и сфингомиелина.
Таблица 1.
| Риск развития РДС (функциональный коэффициента амниотической жидкости лецитин/сфингомиелин (L/S) и фосфатидилглицерол (PG)) |
| Амниотической жидкости Риск РДС L/S>2.0* <.05% L/S < 1.0 100% L/S 1.0 до 2.0 ß как L/S Ý PG имеется <.05% L/S>2.0; PG отсутствует > 80% L/S>2.0; PG имеется 0 * В течение беременности осложненной диабетом или изосерологической несовместимости крови матери и плода, риск РДС с L/S между 2 и 3 - приблизительно 13%. (Contemporary Diagnosis and Management of Neonatal Respiratory Diseases. USA, 1995) |
Факторы снижающие синтез сурфактанта:
· холодовая травма, в том числе использование при ИВЛ не подогретой кислородно-воздушной смеси;
· патологический ацидоз;
· гиповолемия;
· полицитемия;
· гипоксемия;
· гипероксия;
· баротравма и волюмотравма легких;
· инфекции, как анте-, так интра-, постнатальные.
Перечисленные факторы повреждают альвеолы, активируют синтез провоспалительных цитокинов, систему комплемента и хемокинов (анафилотоксины, брадикинин и др.), что приводит к повышенной проницаемости эндотелия и отеку альвеол.
Инактивации сурфактанта, его разрушению способствуют:
· инфекции (особенно грамотрицательные, микоплазменная);
· белки плазмы, протекшие в альвеолы;
· патологический ацидоз;
· избыток оксидантов, перекисных соединений, провоспалительных цитокинов.
Патогенез РДС.
Вследствие неполноценной вентиляции легких развиваются гипоксия и ацидоз. Возникают рефлекторный спазм легочных артериол, отек стенок альвеол, нарушается проницаемость альвеолокапиллярной мембраны. Последнее может привести к выходу плазмы из легочных капилляров в альвеолы, с последующим выпадением на поверхности альвеол фибрина и образованием так называемых гиалиновых мембран (гиалиново-мембранная болезнь). В некоторых случаях гиалиновые мембраны возникают без предшествующих ателектазов легких и еще больше нарушают процесс синтеза сурфактанта, способствуя развитию ателектазов легочной ткани. Вследствие легочной гипертензии, ацидоза нарушается обычная для раннего неонатального периода перестройка кровообращения, в связи, с чем сохраняются фетальные коммуникации - овальное отверстие в межпредсердной перегородке, артериальный (боталлов) проток, соединяющий легочный ствол с аортой. Наличие этих сообщений еще более усугубляет гипоксию. При выраженной гипоксии происходит диссеминированное внутрисосудистое свертывание крови, развивается отечно-геморрагический синдром.
Образование гиалиновых мембран возможно и в результате снижения фибринолитической активности крови. Отмечается также отсутствие или резкое снижение активности антиателектатического фактора (сурфактанта), что способствует возникновению ателектазов. Определенное значение имеет дефицит плазминогена, 2-макроглобулина и развитие локального или диссеминированного внутрисосудистого свертывания крови. Отмечаются недоразвитие эластической ткани легкого, незрелость альвеол, аспирация околоплодной жидкости и слизи, особенно у глубоконедоношенных детей.
Характер и степень выраженности патологических изменений при респираторном дистресс-синдроме во многом зависят от индивидуальных особенностей организма новорожденного. Патогенез РДС рассмотрен на схеме 1.
респираторный дистресс синдром новорожденный

Схема_1
Патофизиология.
Новорожденным с РДС необходим дополнительный кислород и у них увеличена работа дыхания. И то, и другое обусловлено прогрессирующим ателектазированием альвеол вследствие дефицита сурфактанта и чрезмерной податливостью грудной клетки. Пневмоциты ІІ типа довольно чувствительны к гипоксическим инсультам в перинатальном периоде и разрушаются под их воздействием. Созревание этих клеток задерживается при наличии у плода гиперинсулиемии и ускоряется под воздействием хронической внутриутробной гипоксии, обусловленной такими факторами, как гипертония беременных, задержка внутриутробного развития, двойня. Сурфактант, состоящий преимущественно из фосфолипидов и белков, продуцируется и откладывается в пневмоцитах ІІ типа. Этот липопротеин высвобождается в просвет дыхательных путей, где он путем уменьшения поверхностного натяжения и поддержания альвеол в расправленном состоянии при физиологических уровнях давления.
А. Дефицит сурфактанта (рис 2). При отсутствии сурфактанта дыхательные пути с узким просветом и альвеолы спадаются при каждом выдохе, приводит к прогрессирующему ателектазированию легких. Белковый экссудат и эпителиальный дебрис (эпителиальные остатаки), скапливаются в дыхательных путях. Это ведет к уменьшению общей емкости легких. При окрашивание гистологических препаратов этот материал приобретает характерный вид эозинофильных "гиалиновых мембран", дающих основание для установления паталогоанатомического диагноза болезни гиалиновых мембран.
Б. Чрезмерно податливая грудная клетка. Большая величина отрицательного давления, генерируемого для расправления спавшихся дыхательных путей, вызывает появление втяжений и деформаций грудной клетки с незрелыми структурами, формирующими ее каркас (вместо расправления ригидных легких).
В. Шунтирование. Наличие или отсутствие шунтирования крови через открытый артериальный проток и/или овальное окно может оказывать влияние на клинические проявления и течение заболевания. БГМ приводит к развитию ацидоза и гипоксии, которое повышает сосудистое сопротивление в легких. Когда давление в малом круге кровообращения (справа) начинает превышать системное артериальное давление (слева), появляется шунтирование крови справа налево.

Рис.2. Неравномерно расправившееся легкое со спавшими альвеолами при дефиците сурфактанта.
Г. Низкое внутрилегочное давление. У новорожденных с гестационным возрастом менее 30 недель часто уже сразу после рождения развивается дыхательная недостаточность вследствие неспособности генерировать внутрилегочное давление, необходимое для расправления легких без сурфактанта. Кроме того, заболевание нередко осложняется отеком легких, что связано с выраженным левоправым шунтированием крови через открытый артериальный проток или овальное окно. У некоторых новорожденных с дефицитом сурфактанта шунт крови может быть праволевым.
Классификация.
Синдром дыхательных расстройств или "респираторный дистресс синдром" новорождённого представляет тяжёлое расстройство дыхания у детей в первые дни жизни, обусловленное первичным дефицитом сурфактанта. В соответствии с МКБ-10 (Класс XVI "Отдельные состояния перинатального периода", код P22.0) термин "синдром дыхательных расстройств" (СДР.) в настоящее время рассматривается как синоним термина "болезнь гиалиновых мембран" (БГМ). Деление СДР на 2 типа имеет историческое значение и в настоящее время в неонатологии не используется. Согласно МКБ-10, исторически 2-й тип СДР обозначается термином "транзиторное тахипное новорождённых" (код P22.1). В случаях отсутствия дополнительной информации о причине дыхательных расстройств в первые часы жизни может быть использован термин "дыхательное расстройство не уточненное" (код P22.9). Однако на практике его можно применять только в качестве предварительного диагноза. Во избежание терминологической путаницы, для обозначения СДР и БГМ, в качестве синонима этого заболевания, будет использован термин "респираторный дистресс синдром" (РДС).
В настоящие время в Российской федерации пользуются следующей классификацией.
По этиологическому принципу: гипоксической, инфекционной, эндотоксической, инфекционно-гипоксической, генетической (патология сурфактант-ассоциированных протеинов) и т.д. этиологии.
По течению: абортивное, острое, подострое. Наиболее важный вклад в течение рассмотренного заболевания будут вносить врожденные пороки развития сердечно сосудистой системы с изменением кровенаполнения легких, водный баланс на фоне проводимой терапии, изменение реологии крови, функциональное состояние экскреторных систем.
По стадии и тяжести процесса: стадии РДС 0, 1, 2, 3, 4, 5.
0. Стадию повреждения, протекающую внутриутробно или интранатально, позволяющую проводить более ранние лечение и профилактику.
1. Стадию инкубации или скрытую, во время которой компенсаторных механизмов ребенка бывает достаточно для прерывания процесса и самоизлечения.
2. Стадию ”изолированного легочного" поражения, при которой наиболее эффективными элементами вмешательства будут рано начатые респираторная терапия и заместительная терапия сурфактантом.
3. Стадию тотального поражения или шока у новорожденного, в течение которой одна респираторная терапия уже не сможет решать все поставленные задачи и ведение больного требует более сложного медикаментозно-мониторного и лабораторного обеспечения.
4. Стадию полиорганной недостаточности, или ранней постреанимационной болезни, тактика ведения больного в которой должна значительно отличаться в зависимости от преобладания определенного синдрома на определенном промежутке времени.
5. Стадию остаточных проявлений или поздней постреанимационной болезни, протекающей по варианту преобладания легочного, церебрального, трофического, смешанного или иного органического повреждения.
По наличию осложнений: синдром утечки воздуха из легких (пневмоторакс, пневмомедиастинум, пневмоперитонеум, итерстициальная легочная эмфизема), пневмония, ССН, поражение ЦНС (энцефалопатия), поражения ЖКТ (ЯНЭК), ДВС-синдром, шок (гиповолемический, инфекционно-токсический, кардиогенный), генерализованная инфекция.
По исходам и остаточным проявлениям: выздоровление без остаточных проявлений, формирование гиперреактивности бронхов, формирование нейроэндокринной дисфункции, нарушения иммунного статуса, формирование хронического неспецифического заболевания легких (пневмофиброз, хроническая пневмония, буллёзная эмфизема и. т.д.).
Клиническая картина.
Большинство детей рождаются в состоянии асфиксии и врожденной гипоксии.
Расстройство дыхания может наблюдаться с момента рождения (при первичных ателектазах легкого) или спустя несколько часов (при гиалиново-мембранной болезни).
|
|
|


