 |
Потенциал электрода в растворе. Равновесный потенциал.
|
|
|
|
Потенциал электрода в растворе. Равновесный потенциал.
Так как заряд иона относительно велик, а электрическая емкость на границе между металлом и раствором мала, то уже при переходе очень малого количества ионов между металлом и раствором возникает значительная разность потенциалов.
Так, например, при переходе ионов серебра в количестве 10-8 г из раствора в металл, потенциал металла становится положительнее на 0. 5 В.
Энергия ионов металла на электроде и в растворе определяется соответствующей величиной электрохимического потенциала  эх, рассчитываемого согласно соотношению:
эх, рассчитываемого согласно соотношению:
 эх =
эх =  + zi F
+ zi F  ( 1 )
( 1 )
где  - химический потенциал,
- химический потенциал,
zi F  - запас электрической энергии 1 моля вещества (zi - заряд иона,
- запас электрической энергии 1 моля вещества (zi - заряд иона,
F - число Фарадея,  - электрический потенциал данной фазы по
- электрический потенциал данной фазы по
отношению к бесконечно удаленной точке, лежащей в вакууме)
Величина химического потенциала, в свою очередь описывается соотношением
 =
=  iо + RT ln ai ( 2 )
iо + RT ln ai ( 2 )
в котором  iо – величина стандартного химического потенциала, соответствующая
iо – величина стандартного химического потенциала, соответствующая
величине химического потенциала при активности, ионов равной 1.
Тогда, с учетом уравнений (1) и (2) получим:
 эх =
эх =  iо + RT ln ai + zi F
iо + RT ln ai + zi F  ( 3 )
( 3 )
где - два первых слагаемых есть выражение для величины химического потенциала
незаряженных частиц,
- третье - zi F  - запас электрической энергии 1 моля вещества.
- запас электрической энергии 1 моля вещества.
При установлении равновесия, например, на металлическом электроде, погруженном в раствор соли металла электрода, должно установиться равенство электрохимических потенциалов ионов металла на электроде и в растворе:
|
|
|
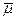 эх =
эх =  эх ( 4 )
эх ( 4 )
(верхняя черта обозначает фазу металла).
В соответствии с уравнением (3), имеем:
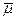 iо + RT ln
iо + RT ln  i + z F
i + z F  =
=  iо + RT ln
iо + RT ln  i + z F
i + z F  ( 5 )
( 5 )
где  - электрический потенциал металла,
- электрический потенциал металла,
 - электрический потенциал раствора.
- электрический потенциал раствора.
Cкачок электрического потенциала между электродом, на котором происходит окислительно-восстановительная реакция, и раствором, устанавливающийся при равенстве скоростей прямой и обратной реакций, называется абсолютным равновесным потенциалом электрода относительно данного раствора - e:
e =  -
-  =
=  ( 6 )
( 6 )
или
e = eо +  ( 7 )
( 7 )
в котором
eо = 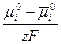 ( 8 )
( 8 )
Уравнение (7) устанавливает зависимость равновесного абсолютного потенциала относительно раствора, в который погружен электрод, от температуры и концентрации (активности) ионов металла в растворе аокисл, которые находятся в окисленной форме, и концентрации (активности) ионов металла в металле авосст.
Если электрод выполнен из какого-либо одного металла, а не сплава, то активность ионов авосст = 1 и вместо уравнения ( 7 ) можно записать:
e = eо +  ( 9 )
( 9 )
где a, Me - активность ионов металла в растворе.
Уравнение ( 9 ) было выведено Вальтером Нернстом и носит его имя.
Как правило, в расчетах используется десятичный логарифм и тогда уравнение ( 9 ) принимает вид:
|
|
|
e = eо +  ( 10 )
( 10 )
Измерение электродного потенциала
Потенциометрический метод основан на измерении разности потенциалов между двумя электродами, погруженными в анализируемый раствор.
Таким образом, необходимая для этого установка должна включать индикаторный электрод, электрод сравнения, и устройство для измерения величины потенциала.
На индикаторном электроде протекает или электрохимическая, или ионообменная реакция с участием определяемого иона, или иона, реагирующего с определяемым. В этой связи индикаторный электрод получил название – ионоселективный.
Ионоселективный электрод и электрод сравнения составляют гальваническую ячейку.
При схематическом изображении различных гальванических элементов используют условную запись, достаточно полно отражающую состав и характерные особенности элемента.
Форма и символика схематического изображения гальванических элементов установлены решением IUPAC. По этим правилам формулы веществ, находящихся в одном растворе, записывают через запятую, а границу между электродом и раствором, или между разными растворами, обозначают вертикальной чертой. Двойная вертикальная черта показывает, что так называемый диффузионный потенциал, возникающий на поверхности раздела растворов разного состава, сведен к минимуму или элиминирован с помощью солевого мостика.
Гальваническую ячейку записывают таким образом, чтобы индикаторный электрод находился справа, а электрод сравнения – слева:
| eэс eдиф e1 e2 e3 | ||||
| электрод сравнения | исследуемый раствор | мембрана | стандартный раствор | внутренний токоотвод |
| аi, x | ||||
На приведенной схеме можно выделить 4 межфазных скачка потенциала:
первый – на границе мембрана - исследуемый раствор,
второй – на границе мембрана - стандартный раствор,
третий – на границе внутренний токоотвод - стандартный раствор,
четвертый – потенциал электрода сравнения.
|
|
|
Электродвижущая сила гальванической ячейки определяется как разность потенциалов индикаторного электрода и электрода сравнения:
Е = eинд - eэс ( 11 )
где eэс - потенциал электрода сравнения,
есть величина постоянная, и может быть найдена в справочнике.
Потенциал приведенной гальванической ячейки определяется алгебраической суммой трех межфазных потенциалов:
eинд = å ei ( 12 )
Термин «алгебраическая сумма» употреблен, поскольку потенциалы e1 и e2 противоположно направлены и межфазный потенциал на границе исследуемый раствор – мембрана e1 входит в сумму в уравнении ( 12 ) со знаком «+».
Тогда
eинд = e1 - e2 + e3 ( 13 )
Так как межфазовые потенциалы e1 и e2 определяются уравнениями Нернста, уравнение ( 13 ) принимает вид:
Е = e1 - e2 + e3 - eст = eо +  ( 14 )
( 14 )
Поскольку активность стандартного раствора ai, ст постоянна, потенциалы e3 и eэс также постоянны, то первые три члена в уравнении
( 14 ) можно объединить в постоянный член (стандартный потенциал) - Ео.
Тогда уравнение для расчета потенциала примет вид:
Е = Ео +  ( 15 )
( 15 )
|
|
|



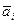
 ai, ст
ai, ст