 |
Каломельный электрод соединяется с анализируемым раствором с помощью солевого мостика, заполненного иммобилизованным сульфатом аммония.
|
|
|
|
Каломельный электрод соединяется с анализируемым раствором с помощью солевого мостика, заполненного иммобилизованным сульфатом аммония.
Величина потенциала каломельного электрода описывается уравнением
Е = Ео, Hg+/Hg - 0, 058 lg [ Cl- ]
и в зависимости от концентрации используемого раствора хлорида калия при 25оС соответственно равна:
- для концентрации хлорида калия 0, 1 М + 0, 3337 В
- для концентрации хлорида калия 1 М + 0, 2881 В
- для насыщенного раствора хлорида калия + 0, 2444 В
Наличие в электрохимической схеме каломельного электрода сульфата аммония приводит к появлению двух диффузионных границ, и, соответственно, двух диффузионных потенциалов.
| |
|  
| ||
| Hg, Hg2Cl2 | KCl | (NH4)2SO4 | ||
Однако, величины диффузионных потенциалов на этих границах, определяемые концентрированным раствором сульфата аммония, близки по величине, противоположны по знаку и взаимно уничтожаются.
Каломельный электрод характеризуется большей стабильностью и используется в основном в научных исследованиях, когда необходимы точные измерения величин потенциалов.
Хлорталлиевый электрод сравнения конструктивно близок к хлорсеребряному: таллиевая проволочка с электролитически нанесенным осадком хлорида таллия, погружена в насыщенный раствор хлорида калия, насыщенный малорастворимым хлоридом таллия.
По причине своей токсичности, хлорталлиевый электрод редко используется в аналитической практике.
Методы рН-потенциометрии
Современное определение рН не имеет строгого термодинамического описания, а является в известной степени условным. Оно основано на измерении разности потенциалов между водородным электродом и электродом сравнения в ячейке без жидкостного соединения:
|
|
|
 Pt, Н2 (газ). Н+ (водн. ), Cl- (водн. ). AgCl (тв. ), Ag
Pt, Н2 (газ). Н+ (водн. ), Cl- (водн. ). AgCl (тв. ), Ag
Э. д. с. такой ячейки определяется выражением:
 ( 1 )
( 1 )
которое, с учетом того, что стандартный потенциал водородного электрода равен нулю, преобразуется в соотношение:
 ( 2 )
( 2 )
где Е - измеряемая э. д. с. ячейки
Ео – стандартный потенциал хлоридсеребрянного электрода сравнения.
При известных величинах коэффициентов активности хлорид-ионов по уравнению ( 2 ) можно рассчитать численное значение величины активности ионов водорода и установить абсолютное значение рН в исследуемом растворе.
В аналитической практике обычно измеряют не абсолютные значения рН, а относительные. Для этого рН исследуемого раствора сравнивают с рН одного или большего числа стандартных растворов сравнения.
Если выбрать электрод сравнения и электрод, обратимый по отношению к ионам водорода, рН исследуемого раствора выразится соотношением:
 ( 3 )
( 3 )
где рНх и рНст – соответствующие значения рН исследуемого и стандартного растворов,
Ех и Ест – значения э. д. с. элемента для определения рН с электродом,
погруженным в исследуемый и стандартный раствор соответственно
Именно это выражение используется при определении рН с помощью иономеров (рН-метров) или потенциометров. Прибор, перед измерением величины рН в исследуемом растворе, настраивается на известное значение рНст стандартного буферного раствора. При этом величина стандартного потенциала используемого электрода сравнения не имеет существенного значения. Необходимо только, чтобы во время проведения измерений эта величина оставалась постоянной.
|
|
|
Предложенная схема определения величины рН в исследуемом растворе реализуется с использованием стеклянного электрода.
Стеклянный электрод для измерения рН был исторически первым ионоселективным электродом.
Хотя чувствительность стеклянного электрода к изменению концентрации ионов водорода была открыта в первом десятилетии ХХ века, однако широкое распространение этот электрод получил лишь после 1922 года, когда были опубликованы результаты сравнительного исследования стеклянного и водородного электродов при определении рН.
По принципу действия стеклянный электрод относится к мембранным электродам следующего типа:
| Ag, AgCl | HCl (0, 1моль/л) | стекло | исследуемый раствор |
Главной частью электрода является тонкая рН-чувствительная мембрана. Обычно ее изготавливают из специального стекла, содержащего 22% оксида натрия, 6% оксида кальция и 72% оксида кремния.
Внутренним раствором электрода служит 0, 1 М раствор соляной кислоты, насыщенный хлоридом серебра.
Устройство стеклянного электрода приведено на рис. 2.

Рис. 2. Стеклянный электрод для измерения рН
1 – верхняя часть корпуса (пластмасса);
2 – средняя часть корпуса (обычное стекло);
3 - тонкостенный шарик из специального стекла, служащий ионочувствительной мембраной;
4 - внутренний вспомогательный хлорсеребряный электрод Ag, AgCl;
5 - 0, 1 н раствор соляной кислоты насыщенный AgCl;
6 - осадок AgCl
При использовании стеклянного электрода для измерения рН следует учитывать, что чувствительностью к ионам водорода обладает только хорошо вымоченная мембрана. Объясняется это тем, что при длительном выдерживании в воде на обеих сторонах мембраны образуется тонкий (порядка 10-4 мм) слой гидратированного геля и все пустоты в трехмерной сетке из атомов кремния и кислорода, составляющей структуру стекла, на поверхности занимают ионы водорода, вытесняя находившиеся там ранее, ионы натрия.
При продвижении вглубь мембраны число пустот, занятых ионами водорода, уменьшается, и увеличивается число пустот, занятых ионами натрия.
Специальными измерениями показано, что ионы водорода не проходят через слой сухого стекла уже при его толщине около 10-1 мм. Внутри такого слоя ток переносится ионами натрия, способными перемещаться внутри пустот на расстояние, равное их нескольким радиусам, и передавать энергию соседним ионам натрия.
|
|
|
Если электрод со стеклянной мембраной поместить в растворитель (например, воду), то ионы водорода начнут переходить в раствор в виде протонов. Отметим, что превалирующий переход катионов в другую фазу характерен только для полярных жидкостей и объясняется большей энергетической выгодностью сольватации катионов, чем электронов.
Вследствие протекания этого процесса, на мембране будет накапливаться отрицательный заряд, так как электроны не переходят в раствор.
Однако, процесс перехода протонов в раствор не бесконечен. По мере его протекания отрицательный заряд на поверхности мембраны увеличивается, и переход в раствор новых протонов становится все менее выгодным. С другой стороны, раствор заряжается все более и более положительно и начинает выталкивать протоны из своего объема на поверхность стеклянной мембраны.
Установившееся равновесие характеризуется равенством скоростей перехода протонов из раствора на стеклянную мембрану и перехода протонов из стеклянной мембраны в раствор. Данное равновесие и называется обратимостью электрода.
Распределение протонов по всему объему раствора неравномерно.
Вблизи границы внешнего раствора со стеклянной мембраной концентрация протонов достаточно высока. Значительное количество протонов находится в первом ряду, непосредственно прилегающем к поверхности стеклянной мембраны, образуя положительную обкладку двойного электрического слоя.
В результате такого процесса между хорошо вымоченной стеклянной мембраной и исследуемым раствором возникает разность потенциалов, определяемая соотношением:
 ( 4 )
( 4 )
где Е1 – потенциал на границе токоотвод – внутренний раствор,
Е2 – потенциал на границе внутренний раствор – внутренняя
поверхность мембраны,
Е3 – потенциал на границе внешняя поверхность мембраны –
|
|
|
исследуемый раствор.
Численные значения потенциалов Е1 и Е2 – постоянные величины для данного электрода.
Е3 в случае стеклянной мембраны равно:

 ,
,  ( 5 )
( 5 )
где Р – константа равновесия электрохимической реакции

при нулевой разности потенциалов между фазами;
Если активность ионов водорода в фазе мембраны,  , не меняется при контакте с раствором и постоянна для данного электрода, константа Р – также величина постоянная, то подставив значение Е3 в уравнение (1), получаем:
, не меняется при контакте с раствором и постоянна для данного электрода, константа Р – также величина постоянная, то подставив значение Е3 в уравнение (1), получаем:
 ( 6 )
( 6 )
или
 ( 7 )
( 7 )
В слагаемое const входят величины потенциалов внешнего и внутреннего электродов сравнения и потенциал асимметрии.
Существование потенциала асимметрии доказано неравенством потенциала электрода нулю при погружении его в раствор, идентичный по составу внутреннему раствору. Причины его появления заключаются в различии структуры и состава внешней и внутренней поверхности мембраны, возникающего из-за улетучивания некоторых компонентов стекла при изготовлении шарика. Потенциал асимметрии может достигать величины, соответствующей одной единице рН. В процессе эксплуатации электрода он продолжает изменяться, так как электрод при этом гидратируется, дегидратируется, протравливается, загрязняется компонентами исследуемых растворов.
Правильные результаты можно получить только при регулярной градуировке электрода по стандартным буферным растворам. При этом, при измерении рН со сравнительно невысокой точностью можно использовать только один буферный раствор. Для более точных измерений необходимо градуировать электрод по двум растворам: в кислой и щелочной средах.
Таблица 1. Буферные смеси для градуировки стеклянного электрода
| Состав буферной смеси | рН (25оС) |
| Гидротартрат калия (насыщ. ) | 3, 557 |
| КНС4Н4О6 (0, 05 М) | 3, 776 |
| Гидрофталат калия (0, 05 М) | 4, 004 |
| КН2РО4 + NaHPO4 (0, 025 М) | 6, 863 |
| КН2РО4 (0, 008695 М) + NaH2PO4 (0, 0343 М) | 7, 415 |
| Na2B4O7 (0, 01 М) | 9, 183 |
| NaHCO3 + Na2CO3 (0, 025 М) | 10, 014 |
Стеклянный электрод пригоден для правильного измерения рН только в ограниченном интервале их значений, зависящем от состава стекла, из которого изготовлена мембрана.
Предполагается, что неправильные результаты в сильнокислых растворах обусловлены разрушением стекла. Знак погрешности измерения рН в щелочных растворах указывает на то, что электрод реагирует не только на ионы водорода, но и на ионы калия и других щелочных металлов.
Действительно, в реальных анализируемых растворах, наряду с ионом Н+, могут находиться и другие катионы. В случае присутствия в растворе катионов калия возможно следующее протекание ионообменной реакции:
|
|
|

которая описывается соответствующей константой обмена:
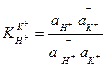 ( 8 )
( 8 )
Величина константы обмена зависит от свойств стеклянной мембраны и температуры. Для обычных стеклянных электродов при комнатной температуре она колеблется от 10-10 до 10-14.
В результате такой реакции активность ионов  в фазе мембраны уменьшится на некоторую величину Х, а равновесная концентрация Н+ соответственно увеличивается на эту же величину Х, что приведет к возрастанию потенциала электрода в соответствии с уравнением:
в фазе мембраны уменьшится на некоторую величину Х, а равновесная концентрация Н+ соответственно увеличивается на эту же величину Х, что приведет к возрастанию потенциала электрода в соответствии с уравнением:
 ( 9 )
( 9 )
При условии, что количество вытеснившихся из стеклянной мембраны в анализируемый водный раствор ионов водорода пренебрежимо мало, по сравнению с концентрациями ионов водорода и калия в анализируемом растворе, выражение для потенциала стеклянного электрода принимает вид:
 ( 10 )
( 10 )
С учетом этого же условия (  ) и (
) и (  ) выражение для константы ионного обмена запишется в виде:
) выражение для константы ионного обмена запишется в виде:
 ( 11 )
( 11 )
Если выразить из последнего соотношение «х», получим:
 ( 12 )
( 12 )
Подставив полученное выражение для «х» в уравнение для расчета величины межфазного потенциала, получим:
 ( 13 )
( 13 )
Окончательное выражение для потенциала стеклянного электрода с учетом величины потенциала электрода сравнения принимает вид:
 ( 14 )
( 14 )
где Ео включает в себя сумму потенциалов внутреннего и внешнего электродов сравнения.
Данное уравнение было выведено академиком Никольским Б. П. в 1937 году и носит его имя.
Хотя уравнение было получено для электрода со стеклянной мембраной, оно широко используется для описания потенциалов жидкостных ионоселективных электродов в смешанных растворах в присутствии мешающих ионов.
В этом случае уравнение Никольского принимает вид:
 ( 15 )
( 15 )
где А- - определяемый ион, В- - мешающий ион,
 - коэффициент потенциометрической селективности электрода относительно мешающего иона.
- коэффициент потенциометрической селективности электрода относительно мешающего иона.
Величина коэффициента селективности определяется экспериментально и зависит от величины соответствующей константы обмена и отношения подвижностей мешающего и определяемого иона в фазе мембраны:
 ( 16 )
( 16 )
где  - величины подвижностей определяемого и мешающего ионов, соответственно.
- величины подвижностей определяемого и мешающего ионов, соответственно.
Из анализа уравнения ( 15 ) следует, что потенциал электрода будет являться функцией концентрации определяемого иона А- при условии, когда
 ( 17 )
( 17 )
Очевидно, данное условие будет выполняться только тогда, когда величина  очень мала (10-5 и ниже), поскольку на практике концентрации определяемого иона (
очень мала (10-5 и ниже), поскольку на практике концентрации определяемого иона (  ) и мешающего иона (
) и мешающего иона (  ) соизмеримы.
) соизмеримы.
Поэтому, поведение электрода в таких системах целиком определяется селективными характеристиками электрода.
Для хороших стеклянных электродов для измерения рН, величина константы потенциометрической селективности  . В соответствии с этим, мешающее влияние ионов натрия проявляется при рН 11-12 (при концентрации натрия 1 М погрешность измерения около –0. 2 единицы рН).
. В соответствии с этим, мешающее влияние ионов натрия проявляется при рН 11-12 (при концентрации натрия 1 М погрешность измерения около –0. 2 единицы рН).
Причиной высокой избирательности стеклянного электрода к иону водорода является то обстоятельство, что фрагмент поверхности стекла является фактически фрагментом кремниевой кислоты, т. е. слабой кислотой (  ;
;  ). Что значит слабая кислота? Это значит, что она плохо диссоциирует на ионы водорода и кислотного остатка. Значит, справедливым будет утверждение, что анион HSiO3 - имеет большое сродство к иону водорода и малое к другим катионам. Естественно, что сказанное, в основном, справедливо для стекла, имеющего одинаковую с кремниевой кислотой ионогенную группу. Для изготовления Н+ - селективного электрода из стекла стараются подобрать такие стекла, чтобы кислота на поверхности была наиболее слабой. И, наоборот, для создания из стекла других электродов (К+, Na+ и т. д. ) подбирают такие сорта стекла, чтобы кислота была более сильной. Это достигается введением в состав стеклянной мембраны окислов других металлов (К2О, CaO, Sb2O3, PbO и т. д. ).
). Что значит слабая кислота? Это значит, что она плохо диссоциирует на ионы водорода и кислотного остатка. Значит, справедливым будет утверждение, что анион HSiO3 - имеет большое сродство к иону водорода и малое к другим катионам. Естественно, что сказанное, в основном, справедливо для стекла, имеющего одинаковую с кремниевой кислотой ионогенную группу. Для изготовления Н+ - селективного электрода из стекла стараются подобрать такие стекла, чтобы кислота на поверхности была наиболее слабой. И, наоборот, для создания из стекла других электродов (К+, Na+ и т. д. ) подбирают такие сорта стекла, чтобы кислота была более сильной. Это достигается введением в состав стеклянной мембраны окислов других металлов (К2О, CaO, Sb2O3, PbO и т. д. ).
|
|
|




