 |
Водородная шкала потенциалов. Схема этой гальванической ячейки записывается в следующем виде. Отсюда. Индикаторные электроды и электроды сравнения
|
|
|
|
Водородная шкала потенциалов
Стандартные химические потенциалы 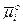 ,
,  входящие в уравнение ( 6 ) неизвестны, и поэтому eо и абсолютный скачок потенциала ea не могут быть рассчитаны. Нет также экспериментальных методов измерения абсолютного скачка потенциала на границе электрод-раствор.
входящие в уравнение ( 6 ) неизвестны, и поэтому eо и абсолютный скачок потенциала ea не могут быть рассчитаны. Нет также экспериментальных методов измерения абсолютного скачка потенциала на границе электрод-раствор.
Поэтому для сопоставления значений потенциалов различных электродов условились измерять их относительно потенциала равновесного водородного электрода в стандартных условиях, при которых активность ионов водорода в растворе, в который погружена платиновая фольга, равна единице, а давление пропускаемого через раствор газообразного водорода равно 1 атм.
Схема этой гальванической ячейки записывается в следующем виде
( Pt ) H2 (p = 1атм) Н+ (аН  ).
).
Выражение для равновесного абсолютного скачка потенциала для водородного электрода можно записать в виде:
eа = eо +  (16)
(16)
На практике водородный электрод представляет собой платиновую проволочку, покрытую каталитически активной платиновой чернью. Проволочка погружена в электролит, через который пропускают чистый газообразный водород. На поверхности проволочки образуется адсорбированный слой молекул водорода, и электрод работает как водородный, поскольку имеет место реакция:

 Н+ + е-
Н+ + е-
За потенциал электрода в водородной шкале электродных потенциалов принимают электродвижущую силу электрохимической системы, составленной из данного электрода и стандартного водородного электрода в соответствующих растворах.
Величина равновесного потенциала электрода в этом случае определяется выражением:
e = eа, Ме + DeМе, Рt - e  = e
= e  (17)
(17)
|
|
|
где  e Me, Pt - скачок потенциала на границе двух металлов: Me и Pt,
e Me, Pt - скачок потенциала на границе двух металлов: Me и Pt,
e a, H  - абсолютный потенциал водородного электрода при стандартных
- абсолютный потенциал водородного электрода при стандартных
условиях.
Разность (eо, Me +  e Me, Pt ) - eоa, Me обозначается eо
e Me, Pt ) - eоa, Me обозначается eо
и называется стандартным потенциалом электрода.
Отсюда
e = eо +  (18)
(18)
Из уравнения ( 3 ) следует, что потенциал электрода является стандартным, когда активность потенциалобразующих ионов в растворе равна 1, т. е. aMe  = 1.
= 1.
В общем случае зависимость потенциала какого-либо электрода от состава раствора и температуры дается уравнением:
e = eо +  (19)
(19)
где eо - стандартный потенциал реакции, протекающей на электроде
аокисл - активность потенциалопределяющих ионов, находящихся в окисленной
форме
авосст - активность потенциалопределяющих ионов, находящихся в
восстановленной форме.
Индикаторные электроды и электроды сравнения
Индикаторный электрод должен быть обратим к потенциал-определяющим ионам, то есть его потенциал должен определяться активностью этих ионов. Индикаторный электрод должен удовлетворять ряду требований. Необходимо, чтобы его потенциал был воспроизводим, и устанавливался достаточно быстро. Электрод должен обладать определенной химической устойчивостью и не вступать во взаимодействия с другими компонентами анализируемого раствора.
В потенциометрии, в качестве индикаторных, используют металлические электроды и мембранные электроды.
Металлические индикаторные электроды в соответствии с составом участников конкретной электродной полуреакции делятся на три основных типа.
К электродам первого рода относятся электроды из металла, например, серебра, погруженных в раствор собственных ионов, например, ионов серебра.
|
|
|
В данном случае электродной реакцией является реакция
Ag - e  Ag+
Ag+
и такие электроды являются индикаторными по отношению к ионам серебра.
Потенциал серебряного электрода описывается соотношением:
Е = ЕОAg+/Ag + 0, 058 lg [Ag+] = 0, 80 + 0, 058 lg [Ag+] (20)
и определяется концентрацией ионов серебра в растворе.
К электродам второго рода относятся электроды, состоящие из металла, покрытого слоем нерастворимой соли этого металла и погруженного в раствор, содержащий растворимую соль, с одноименным анионом нерастворимой соли металла. Типичный пример - хлорсеребряный электрод, состоящий из серебряной проволоки, покрытой слоем хлорида серебра и помещенной в раствор хлорида калия.
При погружении такого электрода в раствор хлорида калия электродную реакцию
Ag + Cl- - e  AgClтв
AgClтв
можно представить в виде суммы основной полуреакции
Ag - e  Ag+
Ag+
и дополнительной
Ag+ + Cl-  AgClтв
AgClтв
В таком случае концентрация ионов серебра в растворе, содержащем хлорид-ионы, будет определяться величиной произведения растворимости осадка хлорида серебра.
Из величины ПРAgCl можно рассчитать величину концентрации ионов серебра в растворе
[Ag+] =  (21)
(21)
Тогда величина потенциала электрода определится соотношениями:
E = EоAg+/Ag + 0, 058 lg [Ag+] = EоAg+/Ag + 0. 058 lg ПРAgCl – 0, 058 lg [ Cl- ] (22)
или
E = Eо, Ag+/Ag - 0, 058 lg [ Cl- ] (23)
где
Eо, Ag+/Ag = EоAg+/Ag + 0, 058 lg ПРAgCl (24)
Из последнего соотношения вытекает непосредственная зависимость потенциала хлорсеребрянного электрода от концентрации хлорид-иона в растворе.
Если концентрация хлорид-ионов в растворе равна 1 моль/л, величина потенциала хлорсеребряного электрода равна + 0, 2363 В.
Металлические электроды третьего рода изготавливаются из такого металла, который может находиться в равновесии с двумя малорастворимыми солями с общим анионом.
Например,
Ag2S(тв)  2Ag+ + S2-
2Ag+ + S2-
CdS(тв)  Cd2+ + S2-
Cd2+ + S2- 
С помощью такого электрода можно определить активность ионов кадмия. При этом необходимо, чтобы вторая соль (CdS) была более растворимой, чем первая (Ag2S).
Также в качестве примера такого электрода, широко используемого в практике, можно привести систему, содержащую ЭДТА, ионы Hg2+ и двух-, трех- и четырехвалентных металлов, в которой малодиссоциируемые комплексы играют ту же роль, что и малорастворимые сульфиды в предыдущем примере.
|
|
|
Существует еще один тип металлических электродов, используемых для контроля величины потенциала реакций окисления-восстановления. Эти электроды изготавливаются из трудно окисляемых металлов (с высоким значением нормального окислительно-восстановительного потенциала EоMe 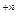 /Me, как, например, у платины, золота и др. )
/Me, как, например, у платины, золота и др. )
Если такой электрод погрузить в раствор, содержащий растворимые компоненты какой-либо окислительно-восстановительной системы, то его потенциал будет определяться соотношением концентраций участников полуреакции (соотношением концентраций окисленной и восстановленной форм) и, следовательно, такой электрод является индикаторным по отношению к этим ионам.
Примером такого электрода является платиновый проводник, погруженный в раствор, содержащий, например, одну из следующих систем: Fe3+/ Fe2+, Ce4+/ Ce3+, MnO4-/ Mn2+, хинон/гидрохинон.
Тогда потенциал электрода выразится уравнением:
E = EоСе  + 0, 058 lg
+ 0, 058 lg  (25)
(25)
|
|
|


