 |
Потенциометрический анализ в неводных средах
|
|
|
|
Потенциометрический анализ в неводных средах
(теоретическая часть)
Потенциометрическое титрование кислот и оснований с константами диссоциации меньше, чем 10-8 в воде практически невозможно, поскольку реакция протекает не полностью и конечную точку титрования трудно зафиксировать.
Однако многие из этих соединений, можно количественно определить титрованием в неводных растворителях, которые обладают способностью усиливать кислотные и основные свойства анализируемых соединений.
Особенно часто потенциометрическое титрование в неводных средах используют в случае нахождения определяемых соединений в многокомпонентных смесях, поскольку в этом случае появляется возможность реализовать на практике отличая в величинах констант диссоциации искомых соединений на 2 и более порядков. При титровании водных растворов смесей кислот требуемые для раздельного определения веществ различия в величинах констант диссоциации не достигаются.
Константа диссоциации одного и того же соединения в большой степени зависит от физико-химических свойств используемого растворителя. Именно поэтому, одно и то же вещество, в зависимости от растворителя, в котором оно растворено, может быть отнесено к классу сильных, или слабых электролитов.
Классификация неводных растворителей
по кислотно-основным свойствам
По своим кислотно-основным свойствам неводные растворители делятся на четыре группы:
1 группа – основные, или протофильные растворители – вещества основного характера, молекулы которых обладают явно выраженным сродством к протону. Оторвать протоны от молекулы протофильного растворителя могут лишь молекулы очень сильных оснований. Примерами таких растворителей являются этилендиамин, диоксан, аммиак.
|
|
|
2 группа – кислые, или протогенные растворители – вещества кислого характера, молекулы которых характеризуются способностью отдавать протоны. Молекулы протогенного растворителя могут присоединять протоны только от сильных кислот. Примерами растворителей этой группы являются фтористоводородная кислота, серная кислота, муравьиная кислота, уксусная кислота.
3 группа – амфотерные, или амфипротные растворители – вещества амфотерного характера, способные выступать в качестве основания по отношению к кислотам, и в качестве кислоты по отношению к основаниям. Молекулы амфипротных растворителей способны как отдавать, так и присоединять протоны. Типичным примером растворителей этой группы является вода, молекулы которой способны отдавать свои протоны, например, аммиаку, и принимать протоны, например, от соляной кислоты.
4 группа – апротонные, или апротные растворители – вещества нейтрального характера, молекулы которых не способны ни отдавать, ни присоединять протоны. Молекулы апротонного растворителя не ионизированы. Примерами растворителей этой группы являются бензол, хлорбензол.
Классификация неводных растворителей
по их влиянию на относительную силу кислот и оснований
С этой точки зрения неводные растворители делятся на две группы:
1 группа – нивелирующие растворители. К ней относятся растворители способные уравнивать силу разных кислот (оснований).
Например, все, так называемые сильные кислоты (хлорная, бромистоводородная, соляная), в результате взаимодействия этих кислот с водой, являющейся слабым акцептором протонов, существуют в водных растворах в виде ионов гидроксония Н3О+ и соответствующих анионов.
Таким образом, под влиянием амфипротного растворителя, воды, являющейся слабым основанием, все сильные кислоты уравниваются в силе. Следовательно, вода оказывает нивелирующее действие на силу кислот.
|
|
|
Жидкий аммиак, отличающийся от воды протофильным характером, является нивелирующим растворителем не только по отношению к сильным, но также и к слабым кислотам.
По аналогии, протогенный растворитель, например, уксусная кислота, является нивелирующим растворителем в отношении сильных оснований, реагируя с большинством из них и уравнивания их по силе со своим ацетат-ионом, являющимся сильным основанием.
2 группа – дифференцирующие растворители. К ним относятся растворители, в среде которых проявляются значительные различия в силе кислот, оснований.
Например, безводная уксусная кислота, являющаяся слабым акцептором протонов, проявляет дифференцирующие свойства в отношении сильных кислот: хлорной, соляной, бромистоводородной, серной, азотной и др.
Хлорная кислота является наиболее сильной кислотой и поэтому практически полностью реагирует с уксусной кислотой в соответствии с уравнением:
СН3СООН + НСlО4  СН3СОО(Н2)+ + СlО4-
СН3СОО(Н2)+ + СlО4-
Хлористоводородная кислота и другие кислоты в среде безводной уксусной кислоты проявляют более слабые кислотные свойства по сравнению с хлорной кислотой, чем в водных растворах. При этом в среде безводной уксусной кислоты сильные кислоты проявляют свои протоно-донорные свойства в зависимости от величин их констант кислотности Ка и располагаются по силе в следующий ряд:
НСlО4 > CH3C6H4SO3H > HBr > H2SO4 > HCl > HNO3
В очень сильно протонированных растворителях кислоты с малыми значениями величин констант диссоциации, например, карбоновые кислоты, вообще не проявляют кислотных свойств. По-видимому, у таких протогенных растворителей дифференцирующий эффект связан с подавлением сильными кислотами процесса диссоциации слабых кислот и усилении процесса ассоциации ионов в их среде.
По мере усиления протогенного характера растворителя все меньшее число кислот способны проявлять кислотные свойства в их среде, т. е. происходит дифференцирование их силы.
Вместе с тем, в тех же растворителях происходит нивелирование силы оснований.
И наоборот, жидкий аммиак, являющийся более сильным основанием, чем вода, проявляет себя дифференцирующим растворителем по отношению к сильным основаниям, являясь одновременно нивелирующим растворителем в отношении кислот.
|
|
|
Степень дифференцирующего влияния того или иного растворителя определяется численным значением разности показателей констант диссоциации (  ) растворенных веществ 1 и 2 (рК1 и рК2) в данном растворителе по сравнению с другим растворителем:
) растворенных веществ 1 и 2 (рК1 и рК2) в данном растворителе по сравнению с другим растворителем:

Так, например, в водных растворах величина рК салициловой кислоты равна 2. 97, а величина рК пикриновой кислоты равна 0. 80. Соответственно разность величин констант диссоциации этих кислот в воде равна:

Именно по причине этой малой разности, при титровании смеси этих кислот в водном растворе удается установить только их суммарное содержание в анализируемой пробе. На кривой титрования пробы раствором щелочи наблюдается только один скачок.
В таком дифференцирующем растворителе как ацетон, рК салициловой кислоты оказывается равной 9. 53, а рК пикриновой кислоты равна 3. 17. Разность величин констант диссоциации кислот в ацетоновых растворах равна:
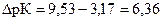
При переходе от водных растворов к ацетоновым растворам этих кислот, разность величин констант диссоциации возрастает более чем в три раза. Это обстоятельство и свидетельствует о том, что ацетон, по сравнению с водой, является дифференцирующим растворителем для салициловой и пикриновой кислот.
Если выполнять титрование смеси кислот в смешанном водно-ацетоновом растворе, то при соотношении объемов индивидуальных растворителей ацетон: вода = 1: 1, разность в величинах констант диссоциации кислот составляет величину, равную уже 4 единицам и на кривой титрования удается зафиксировать два скачка. Однако, поскольку регистрируемые скачки недостаточно четкие, установить точное количественное содержание каждой из кислот невозможно. Только при выполнении титрования смеси кислот в индивидуальном ацетоне создаются условия для точного количественного определения содержания каждой из кислот.
|
|
|


