 |
Уравнение состояния рабочего тела
|
|
|
|
Основные параметры состояния рабочего тела (газа) зависят друг от друга и связаны уравнением вида F(υ, p, T) = 0. Зависимость, связывающая между собой параметры состояния, называется уравнением состояния.
Из общего уравнения следует, что для определения состояния тела достаточно знать только два параметра, а третий параметр и все остальные могут быть найдены из уравнения состояния и других термодинамических зависимостей.
Уравнение состояния для идеального газа выводится на основе молекулярно–кинетической теории газов и имеет вид, для 1 кг газа:
Р · υ = R · T.
Это уравнение называется характеристическим уравнением или уравнением Клапейрона.
Величина R – называется газовой постоянной, и для каждого газа имеет свое постоянное значение.
Размерность величины R определяется из выражения:
 .
.
Если уравнение состояния отнести к т кг газа, оно примет вид:

где V = m · υ – есть полный объем данного количества газа, м3.
Используя приведенные формы уравнения состояния, можно найти любую из величин, входящих в него, если известны или заданы остальные. Для практических расчетов все величины, входящие в уравнение состояния, следует подставлять в единой системе единиц СИ.
Если уравнение состояния отнести к 1 киломолю газа, то оно становится универсальным уравнением состояния для любого газа:
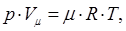

где μ –молекулярный вес газа, 1 киломоль равен μ кг газа;
Vμ – объем 1 киломоля газа, = 22,4 м3/кМоль;
μR – киломольная газовая постоянная.
В соответствии с законом Авогадро при постоянном давлении и температуре 1 киломоль любого газа имеет один и тот же объем. Из уравнения состояния для 1 киломоля газа следует, что если для любого газа величины p, T и Vμ одинаковы, то и величина μR имеет одно и то же значение для всех газов.
|
|
|
Поэтому величина μR называется универсальной газовой постоянной, а уравнение состояния для 1 киломоля газа универсальным уравнением состояния или уравнением Менделеева–Клапейрона.
Универсальную газовую постоянную можно найти из условия, что при нормальных условиях (t = 0°С, р = 760 мм. рт. ст. или Т = 273,15 К; р = 101330 Па) 1 киломоль любого газа имеет объем Vμ = 22,4 м3, откуда:
 .
.
Из условия:  ,
,
можно найти газовую постоянную для любого газа:
 .
.
Смеси газов
В большинстве случаев на практике рабочими телами является не один газ, а смесь нескольких газов, являющихся компонентами смеси. Например: воздух, природный газ, продукты сгорания топлива (N2, CO, CO2, SO3, O2 и т.д.). Поэтому необходимо знать характерные особенности газовых смесей и их законов поведения.
1. Общая характеристика смеси газов
Смесь газов – это механическая смесь нескольких идеальных газов, не вступающих в химические реакции друг с другом.
Главный принцип, определяющий свойства газовой смеси, принцип независимости действия газов в смеси, т.е. каждый газ в смеси действует независимо от других газов, не меняет своих свойств и подчиняется всем газовым законам.
Кроме того, каждый газ занимает весь объем смеси и все газы в смеси имеют одинаковую температуру, а свойства смеси газов складываются из свойств всех ее компонентов.
Из этого следует, что давление смеси равно сумме парциальных (частичных) давлений компонентов (закон Дальтона):
 .
.
Парциальным давлением называется давление, создаваемое молекулами данного отдельного компонента в газовой смеси. Оно определяется как давление, которое имел бы данный компонент, если он один занимал бы весь объем смеси при той же температуре.
|
|
|
Парциальное давление вычисляется по уравнению состояния данного компонента:
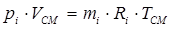 .
.
Для сравнения газов входящих в смесь по объему вводится понятие парциального объема. Парциальным (приведенным) объемом данного компонента называется условный объем, который имел бы данный компонент, если он один находился при температуре и давлении смеси.
Парциальный объем вычисляется по уравнению состояния данного компонента:
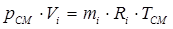 .
.
Из равенства уравнений состояния следует:
 .
.
Суммируя полученное уравнение по всем компонентам газовой смеси, получим:
 .
.
т. к. по закону Дальтона  .
.
2. Способы задания состава смеси
Свойства газовой смеси в первую очередь зависят от ее состава, который может быть задан следующими способами:
– массовая доля – отношение массы компонента к массе смеси:

– объемная доля – отношение парциального объема компонента к объему смеси:

– мольная доля – отношение числа молей компонента к суммарному числу молей смеси:
 .
.
Т. к. по закону Авагадро объемы 1 киломоля всех газов при нормальных (одинаковых) условиях одинаковы, то можно доказать, что если:

то есть, последние два способа задания состава эквивалентны.
Соотношение между массовой и мольной долей можно найти из уравнения:
 .
.
В итоге имеем следующие соотношения:
 .
.
В полученных уравнениях μСМ – средний (кажущийся) молекулярный вес данной газовой смеси, т.е. молекулярный вес такого условного однородного газа, который по своим свойствам аналогичен данной газовой смеси.
Исходя из этого, величина μСМ определяется по составу смеси следующим образом:
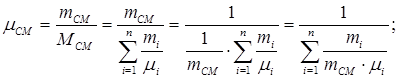
Так как соотношение:  .
.
Складывая зависимости для величины gi по всем компонентам газовой смеси, имеем:
 .
.
После преобразований получим:
 .
.
Уравнение состояния для газовой смеси может быть принято по следующим соображениям. Из принципа независимости следует, что если каждый газ в смеси независимо от других подчиняет уравнению состояния, то и вся смесь может рассматриваться, как один однородный газ со своими особыми свойствами, который так же подчиняется уравнению состояния, т.е.
 .
.
где RCM – средняя кажущаяся газовая постоянная смеси, определяемая на основе среднего молекулярного веса смеси:
|
|
|
 .
.
Величина RCM может быть также найдена по составу смеси после подстановки зависимостей для μСМ:

Другая зависимость:
 .
.
Теплоемкость газов
Подвод (или отвод) тепла к телу в процессе вызывает изменение параметров состояния, главным образом температуры. Поэтому для вычисления количества тепла при изменении состояния тела можно использовать изменение температуры и величину, характеризующую свойства тела. Величина, характеризующая способность тела изменять температуру в процессах с подводом (или отводом) тепла называется теплоемкостью.
Теплоемкостью тела называется количество тепла, которое необходимо подвести (или отвести) к телу, чтобы изменить его температуру на 1 К.
Удельной теплоемкостью называется теплоемкость, отнесенная к единице массы вещества.
Понятие теплоемкости используется для вычисления количества тепла участвующего в процессе.
В зависимости от того, к какой единице массы относится теплоемкость, различают три вида удельной теплоемкости.
Массовой теплоемкостью называется удельная теплоемкость, отнесенная к 1 кг массы газа. Она обозначается С и имеет размерность Дж/(кг· K), кДж/(кг·K).
Объемной теплоемкостью называется теплоемкость, отнесенная к массе газа, содержащегося в 1 м3 газа, взятом при нормальных условиях. Она обозначается с/ и имеет размерность Дж/(нм3·К), кДж/(нм3·К).
Киломольной или молярной теплоемкостью называется теплоемкость, отнесенная к 1 киломолю газа. Она обозначается μС и имеет размерность Дж/(кмоль·K).
Связь между разными видами удельной теплоемкости следующая:
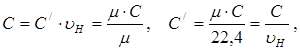
где υН – удельный объем газа, взятого при нормальных условиях и равный  м3/кг.
м3/кг.
Исходя из принятой характеристики удельной теплоемкости, количество тепла в процессе может быть определено по следующим формулам:

где 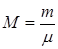 – число киломолей рабочего тела;
– число киломолей рабочего тела;
 – объем рабочего тела при нормальных условиях, м3.
– объем рабочего тела при нормальных условиях, м3.
Приведенные уравнения справедливы при условии постоянного значения теплоемкости в заданном интервале температур, либо если теплоемкость принимается постоянной условно.
|
|
|
В действительности теплоемкость изменяется в зависимости от вида процесса, в котором участвует газ, а для данного процесса изменяется с изменением температуры. Графическая зависимость теплоемкости от температуры представлена на рисунке 1.1.
 |
Рисунок 1.1 – Зависимость теплоемкости газа от температуры
Для бесконечно малого участка зависимости С = f(t) истинная теплоемкость при данной температуре тела t, для 1 кг массы может быть определена из условия:

откуда:  .
.
При изменении температуры рабочего тела в процессе от t1 до t2 количество тепла участвующего в процессе на 1 кг массы тела будет равно:

где, очевидно, что: C = f(t).
Величина истинной теплоемкости, определяется для разных веществ экспериментальным путем и обычно выражается степенной зависимостью вида:

где a0, a1, a2, a3 – эмпирические коэффициенты.
Для упрощения практических расчетов по определению количества тепла вводится условное понятие средней удельной теплоемкости тела в данном процессе, которая для 1 кг массы в интервале температур от t1 до t2 будет равна:
 .
.
Использование средней теплоемкости облегчает задачу вычисления количества тепла в процессе, т.к. в этом случае:
 .
.
Значения средней теплоемкости также определяются экспериментальным путем, а для расчетов задаются в виде таблиц или эмпирических зависимостей.
Так как в практических расчетах может потребоваться значение средней теплоемкости в любом интервале температур, то в таблицах и формулах задается значение средней теплоемкости с фиксированным нижним пределом, равным 0°С, т.е. средняя теплоемкость задается только в интервале температур от 0° до t °С, и может быть использована для расчета количества тепла в любом интервале температур путем следующего преобразования. Из условия  следует, что:
следует, что:
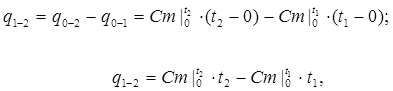
откуда средняя теплоемкость в данном интервале температур равна:
 .
.
Величина теплоемкости сильно зависит так же от условий протекания процесса и для каждого процесса имеет свое определенное значение. При этом ее значение меняется от ± 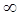 (для изотермического процесса, dT=0) до 0 (для адиабатного процесса, dq=0). Так как число различных термодинамических процессов бесконечно велико, то также велико и число значений теплоемкости в процессах. Для вычисления величины теплоемкости в любом процессе вводятся две основные, стандартные теплоемкости для двух, (принятых за опорные значения) процессов. Это теплоемкость в процессах, протекающих при постоянном давлении, она обозначается Ср и теплоемкость при постоянном объеме – Сυ.
(для изотермического процесса, dT=0) до 0 (для адиабатного процесса, dq=0). Так как число различных термодинамических процессов бесконечно велико, то также велико и число значений теплоемкости в процессах. Для вычисления величины теплоемкости в любом процессе вводятся две основные, стандартные теплоемкости для двух, (принятых за опорные значения) процессов. Это теплоемкость в процессах, протекающих при постоянном давлении, она обозначается Ср и теплоемкость при постоянном объеме – Сυ.
|
|
|
Связь между ними устанавливается уравнением Майера:
Ср – Cυ = R, кДж/кг·К– для 1 кг газа;
μCp – μCυ = 8,3142, кДж/Кмоль·К – для 1 кмоля.
В термодинамике часто используется также отношение:
 которое называется коэффициентом Пуассона.
которое называется коэффициентом Пуассона.
В таблицах и эмпирических формулах для истинных и средних теплоемкостей задаются только два значения теплоемкости Ср или Сυ, a теплоемкость в остальных процессах вычисляется с их помощью в зависимости от характеристики данного процесса.
При обозначениях теплоемкостей учитываются указанные выше обозначения ее видов. Например, μCυ – истинная, киломольная теплоемкость при постоянном объеме,  – средняя, объемная теплоемкость при постоянном давлении и т.д.
– средняя, объемная теплоемкость при постоянном давлении и т.д.
Теплоемкость газовых смесей определяется как сумма теплоемкостей входящих в ее состав компонентов с учетом их количественных соотношений.
Для 1 кг смеси газов, массовая теплоемкость будет равна:
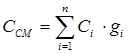 .
.
Для 1 нм3 смеси газов, объемная теплоемкость будет равна:
 .
.
|
|
|


