 |
Исследование частных случаев политропного процесса
|
|
|
|
Исследование выполняется на основе уравнений общего, политропного процесса в следующей последовательности:
– на основе общей характеристики процесса для данного частного случая определяется значение величины теплоемкости процесса;
– по величине теплоемкости процесса вычисляется значение показателя политропы, соответствующее данному частному случаю;
– подставляя полученные значения теплоемкости и показателя политропы в уравнения общего термодинамического процесса, получим все необходимые уравнения, характеризующие данный термодинамический процесс, как частный случай общего процесса;
– по полученным уравнениям этих процессов в диаграммах p – υ и T – S наносятся линии процессов в указанных диаграммах. Для большей наглядности p – υ и T – S – диаграмм, где на концах линий процессов указывается соответствующее значение показателя политропы, в одинаковых процессах обозначены:
– процесс с подводом тепла (1–2);
– процесс с отводом тепла (1–2/ ).
Графический анализ термодинамических процессов представлен на рисунке 1.4.
1. Исследование изохорного процесса
Условие протекания изохорного процесса υ = const, откуда следует, что C = CV.
Подставляя значение теплоемкости в уравнение 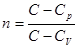 , получим
, получим  .
.
Подставляя полученные значения  и C = CV в уравнение общего процесса, получим:
и C = CV в уравнение общего процесса, получим:
– уравнение изохорного процесса в диаграмме р – υ из р · υn = const, или p1/n · υ = const, чтопри  , дает выражение υ = const;
, дает выражение υ = const;
– уравнение изохорного процесса в диаграмме T – S из S = C · ln T+A, что при C = CV дает выражение S = CV · ln T+A;
– соотношение параметров в изохорном процессе (при  ; С = СV и υ1 = υ2):
; С = СV и υ1 = υ2):
 ; (закон Шарля)
; (закон Шарля)



– работа и тепло в изохорном процессе из уравнения q = C · (T2 – T1) при C = CV определяются по уравнениям:
|
|
|
 ;
;
из уравнения  при
при  , имеем lV = 0.
, имеем lV = 0.





Рисунок 1.4 – Графический анализ термодинамических процессов
Линия процесса (изохора) прямая, параллельная оси p в диаграмме p– υ и логарифмическая кривая в диаграмме T – S.
2. Исследование изобарного процесса
Условие протекания изобарного процесса p = const, откуда следует, что: C = Cp.
Подставляя значение теплоемкости в зависимость для n, получим n = 0.
Подставляя значения n = 0 и C = Cp в уравнение общего процесса, получим:
– уравнение изобарного процесса в диаграмме p – υ из p · υn = const, при n = 0 имеем p = const;
– уравнение изобарного процесса в диаграмме T – S, из S = C ·ln T+A, при C = Cp имеем S = Cp ·ln T+A;
– соотношение параметров в изобарном процессе (при n = 0; C = Cp; p1 = p2 = p):
 ; (закон Гей-Люссака)
; (закон Гей-Люссака)


 ;
;
– работа и тепло в изобарном процессе:
 .
.
Линия процесса (изобара) – прямая, параллельная оси υ в диаграмме p – υ и логарифмическая кривая, проходящая менее круто, чем изохора, в диаграмме T – S.
3. Исследование изотермического процесса
Условия протекания изотермического процесса T = const, откуда следует, что: dT = 0 и  .
.
Подставляя значение теплоемкости в уравнение показателя политропы

получим п=1.
Подставляя значения п=1 и  в уравнение общего процесса, получим:
в уравнение общего процесса, получим:
– уравнение изотермического процесса в диаграмме р – υ из условия, что р · υп = const и n = 1 представляет собой симметричную гиперболу
 ;
;
– уравнение изотермического процесса в диаграмме T – S из условия, что S = C · ln T+A и S/C = ln T+A при  представляет собой горизонтальную прямую, параллельную оси S (
представляет собой горизонтальную прямую, параллельную оси S ( );
);
– соотношение параметров в изотермическом процессе:

 ; (закон Бойля-Мариотта)
; (закон Бойля-Мариотта)
 ;
;  ;
;
 – это неопределенность, требующая вывода нового уравнения для разности S2 – S1 в изотермическом процессе;
– это неопределенность, требующая вывода нового уравнения для разности S2 – S1 в изотермическом процессе;
– работа и тепло в изотермическом процессе:
|
|
|
 – это неопределенность, требующая вывода нового уравнения для вычисления количества тепла qT в изотермическом процессе;
– это неопределенность, требующая вывода нового уравнения для вычисления количества тепла qT в изотермическом процессе;
 – это неопределенность, требующая вывода нового уравнения для вычисления количества работы в изотермическом процессе.
– это неопределенность, требующая вывода нового уравнения для вычисления количества работы в изотермическом процессе.
Вывод нового уравнения работы в изотермическом процессе выполняем исходя из общего выражения dl = p · dυ, следовательно:
 .
.
Из уравнения изотермы в диаграмме p – υ имеем:
 .
.
Подставляя последнее выражение p в подинтегральное выражение, получим:
 .
.
Используя уравнение состояния и уравнение соотношения параметров, получим различные виды уравнения работы в изотермическом процессе:

Из уравнения первого закона термодинамики для изотермического процесса следует, что qT = u2 – u1 + lT, но т.к. u2 – u1 = 0, то:

Из выражения дифференциала энтропии для условий изотермического процесса (T = const) следует:
– если  то при T = const, интегрируя, имеем
то при T = const, интегрируя, имеем
 ,
,
откуда: 
Кривая процесса (изотерма) представляет собой равнобокую гиперболу в диаграмме р – υ и прямая, параллельная оси S, в диаграмме T – S.
4. Исследование адиабатного процесса
Условие протекания процесса dq = 0, т.е. тепло не подводится и не отводится, откуда следует, что C = dq/dt = 0. Подставляя значение теплоемкости в уравнение  получим:
получим:  ,
,
где k – показатель адиабаты, который имеет значение от 1,3 до 1,6.
Подставляя значения  и C = 0 в уравнение общего процесса, получим:
и C = 0 в уравнение общего процесса, получим:
– уравнение адиабатного процесса в диаграмме p – υ, которое из условия p · υп = const и при n = k имеет вид несимметричной гиперболы (p · υk = const);
– уравнение адиабатного процесса в диаграмме T – S, которое из условия S = C ·ln T + A и при С = 0 представляет собой вертикальную прямую (S = A = const), т.е. адиабатный процесс – это одновременно и изоэнтропийный процесс;
– соотношение параметров в адиабатном (изоэнтропийном) процессе: (при n = k; C = 0 u S1 = S2):



 ;
;
– работа и тепло в адиабатном процессе:
qA = 0; 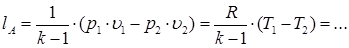
Из приведенного анализа следует, что соотношение параметров, работа, изменение внутренней энергии и энтальпии, аналогичны политропному процессу при значении n = k.
Кривая процесса (адиабата) представляет собой неравностороннюю гипербола в диаграмме p – υ и прямую, параллельную оси T в диаграмме T – S.
|
|
|
1.2.9 Анализ общих характеристик политропных процессов в диаграммах p – υ и T – S
Все политропные процессы, представленные на рисунке 4, по основным характеристикам делятся на следующие виды.
1. Процессы расширения, в которых совершается полезная работа, отводимая в окружающую среду (dυ>0 и dl>0), и процессы, сжатия, в которых затрачивается работа, подводимая из окружающей среды (dυ<0 и dl<0).
Границей между процессами расширения и сжатия служит изохора ( ).
).
2. Процессы с подводом тепла (dS>0 и dq>0) и процессы с отводом тепла (dS<0 и dq<0).
Границей между процессами подвода и отвода тепла служит адиабата (n = k).
3. Процессы с увеличением внутренней энергии рабочего тела (dT>0 и dU>0) и процессы с уменьшением внутренней энергии (dT<0 и dU<0).
Границей между процессами увеличения и уменьшения внутренней энергии служит изотерма (n = 1).
В соответствии с вышеизложенным принято разделять все политропные процессы расширения и сжатия на 3 группы (Рисунок 4).
Первую группу составляют политропные процессы, имеющие значение n в пределах 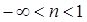 .
.
Процессы расширения в первой группе имеют следующие характеристики: dυ>0; dS>0; dS>0 и, следовательно, l>0; q>0 и ∆U>0, т.е. подводимое тепло в этих процессах расходуется на совершение работы и увеличение внутренней энергии рабочего тела.
Процессы сжатия в первой группе имеют характеристики: dυ<0; dS<0; dT<0 и, следовательно, l<0 и q<0; ∆U<0, т.е. уменьшение внутренней энергии и затраченная работа, взятая из окружающей среды, расходуются на тепловую энергию, отводимую в окружающую среду.
Вторую группу составляют политропные процессы, имеющие показатель п в пределах 1<n<k.
Процессы расширения во второй группе имеют следующие характеристики: dυ>0; dS>0; dT<0 и, соответственно, l>0; q>0 и ∆U<0, т.е. работа в этих процессах совершается счет уменьшения внутренней энергии рабочего тела и тепловой энергии, подводимой извне.
Процессы сжатия во второй группе имеют характеристики: dυ<0; dS<0 и dT>0 и, соответственно, l<0; q<0, и ∆ U>0, т.е. работа сжатия, подводимая извне, затрачивается на увеличение внутренней энергии рабочего тела и тепло, отводимое в окружающую среду.
|
|
|
Третью группу составляют политропные процессы, имеющие показатель n в пределах  .
.
Процессы расширения в третьей группе имеют характеристики: dυ>0; dS<0; dT<0, откуда l>0; q<0; ∆U<0, т.е. в этих процессах внутренняя энергия расходуется на полезную работу и тепло, отводимые в окружающую среду.
Процессы сжатия в третьей группе имеют характеристики: dυ<0; dS>0; dT>0, откуда l<0; q>0; ∆U>0, т.е. в этих процессах увеличение внутренней энергии происходит за счет работы сжатия и тепловой энергии, подводимых извне.
В теплотехнике, в тепловых двигателях, наибольшее применение имеют политропные процессы второй группы.
|
|
|


