 |
Исследование общего термодинамического процесса
|
|
|
|
1. Основные определения и условия исследования
Общим термодинамическим процессом называется процесс протекающий при одновременном изменении всех параметров состояния. Такой процесс в термодинамике называется политропным.
Исследование проводится на основе первого закона термодинамики, уравнения состояния и характеристики параметров состояния U, i и S.
Задача исследования термодинамического процесса состоит в следующем:
– вывод уравнения процесса в p – υ и T – S – диаграммах;
– установление зависимости между параметрами состояния в начале и в конце процесса;
– определения величины изменений внутренней энергии, энтальпии и энтропии;
– определение количества работы и тепла в процессе.
Все процессы считаются обратимыми. Для упрощения задачи все процессы принято считать протекающими при постоянной теплоемкости (С), которая для каждого отдельного процесса имеет строго определенное значение, но в общем случае, для разных процессов может принимать значения от  до
до  .
.
Частными случаями политропного процесса являются процессы, протекающие при постоянном значении одного параметра состояния и переменных значениях всех остальных параметров. К ним относятся следующие процессы:
– изохорный процесс, протекающий при постоянном объеме;
– изобарный процесс, протекающий при постоянном давлении;
– изотермический процесс, протекающий при постоянной температуре;
– адиабатный процесс, протекающий при отсутствии теплообмена с внешней средой (т.е. dq = 0), при этом dS = 0 и энтропия не меняется, т.е. процесс является изоэнтропийным (S = const).
Изучение этих процессов имеет большое теоретическое и практическое значение в технике.
|
|
|
2. Вывод уравнения политропного процесса в p – υ – диаграмме
Рассмотрим произвольный, бесконечно малый участок политропного процесса, для которого можно записать два выражения уравнения первого закона термодинамики в дифференциальной форме, образующих систему дифференциальных уравнений:
 .
.
Используя понятие постоянной теплоемкости политропного процесса (С) и выведенные в п. 2.6 выражения для dU и di, будем иметь:
dq = C · dT; dU = Cυ · dT; u di = Cp · dT.
Подставляя эти выражения в систему дифференциальных уравнений, получим:
C · dT = CV · dT + p · dυ;
C · dT = Cp · dT – υ · dp.
Перенося члены уравнения, содержащие дифференциал dT в левую часть и разделив второе уравнение на первое, получим:
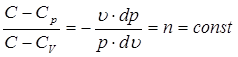 ,
,
где 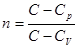 – постоянная величина, называемая показатель политропы.
– постоянная величина, называемая показатель политропы.
В свою очередь, теплоемкость политропного процесса может быть выражена через показатель политропы таким образом:
 где
где  .
.
Величины n и С являются основными характеристиками политропного процесса и определяют все его свойства. При этом, для характеристики политропного процесса достаточно задать только одну величину n или С, вторая может быть найдена из приведенного уравнения связи между ними.
Разделяя переменные в полученном дифференциальном уравнении, и интегрируя, получим:

где N – постоянная интегрирования.
Постоянная интегрирования определяется обычно по начальным и конечным граничным условиям процесса.
Так как уравнение политропного процесса справедливо для всех точек процесса, в том числе и для первой и последней точки процесса, постоянная интегрирования будет равна:

Уравнение политропного процесса в p – υ – диаграмме представляет неравнобокую гиперболу.
3. Вывод уравнения политропного процесса в T – S – диаграмме
Для бесконечно малого участка политропного процесса изменение энтропии равно:
|
|
|
 .
.
Используя значение постоянной теплоемкости политропного процесса (С), получим:
 .
.
Интегрируя последнее выражение, имеем:
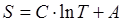 ,
,
где А – постоянная интегрирования, определяемая, обычно, по начальным условиям. Используя значения параметров T и S в начальной или конечной точке процесса, найдем постоянную интегрирования:

откуда  .
.
Тогда уравнение политропы можно записать в виде:
 .
.
Уравнение политропного процесса в T – S – диаграмме представляет логарифмическую кривую.
4. Зависимость между начальными и конечными параметрами состояния p, υ и T в процессе
Исходными уравнениями для вывода зависимостей являются уравнения состояния и уравнение политропы для начальной и конечной точки процесса: 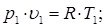


Разделив первое уравнение состояния на второе, получим общее уравнение связи между параметрами p, υ, T:
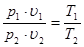 .
.
Из уравнения политропы получим зависимость между начальным и конечным давлением и объемом:
 .
.
Подставляя отношение давлений в общее уравнение, получим:
 .
.
Аналогично, подставляя отношение объемов, будем иметь:
 .
.
Подученные выражения могут быть использованы для определения неизвестного параметра, либо для вычисления показателя n.
5. Определение изменения величин u, i, S
Используя выражения, выведенные в п. 2.6 для определения энергетических параметров, получим формулы их изменения в процессах:
– для изменения внутренней энергии в процессе (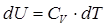 ), интегрируя, получим:
), интегрируя, получим:

– для изменения энтальпии в процессе ( ) интегрируя, будем иметь:
) интегрируя, будем иметь:
 ;
;
– для изменения энтропии в процессе ( ) с учетом, что (
) с учетом, что (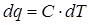 ), по итогам интегрирования, получим:
), по итогам интегрирования, получим:
 .
.
Заменяя отношение температур, отношением других параметров, можно выразить ∆ S1–2 через изменение других параметров.
6. Определение количества тепла в процессе
Из выражения dq = С · dТ, в результате интегрирования получим:
 .
.
7. Определение количества работы в политропном процессе
Из выражения dl = p · dυ, интегрируя в пределах от 1 до 2, получим:
 где
где  .
.
Выразим функцию давления p = f(υ) из уравнения политропного процесса в p – υ – диаграмме:

Откуда давление будет равно:
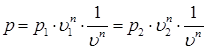 .
.
Подставляя в подинтегральное выражение полученное значение р, будемиметь:
|
|
|
 .
.
Преобразуем полученное выражение с целью упрощения:
 .
.
Используя уравнение состояния идеального газа, получим:
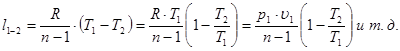
|
|
|


