 |
Тема 1. Микроэкономические аспекты инновационной деятельности
|
|
|
|
Содержание
I ОСНОВЫ ЭКОНОМИКИ И ИННОВАЦИОННОЙ ДЕЯТЕЛЬНОСТИ.. 1
Тема 1 Микроэкономические аспекты инновационной деятельности. 1
Тема 2 Институт собственности и инновации. 3
Тема 3 Основы управления и защиты результатов интеллектуальной деятельности. 5
Тема 4 Оптимизация инновационных решений. 11
Тема 5 Конкуренция на рынке инноваций. 13
Тема 6 Экономическая стратегия и экономическая политика в сфере инноваций. 14
Тема 7 Инвестиционная деятельность организации. 15
II УПРАВЛЕНИЕ БИОТЕХНОЛОГИЧЕСКИМ ПРОИЗВОДСТВОМ... 19
Тема 8 Основы стратегического менеджмента. 19
Тема 9 Содержание процесса управления. 20
Тема 10 Организационные структуры в управлении биотехнологическом производством.. 21
Тема 11 Основы управления персоналом в биотехнологическом производстве. 23
Тема 12 Риск-менеджмент и его особенности в инновационной сфере. 24
III ОРГАНИЗАЦИЯ БИОТЕХНОЛОГИЧЕСКОГО ПРОИЗВОДСТВА.. 24
Тема 13 Состояние и перспективы развития биотехнологических производств как основы VI технологического уклада. 25
Тема 14 Производственный процесс: принципы организации. 29
I. ОСНОВЫ ЭКОНОМИКИ И ИННОВАЦИОННОЙ ДЕЯТЕЛЬНОСТИ
Тема 1. Микроэкономические аспекты инновационной деятельности
Инновация возникает в результате использования результатов научных исследований и разработок, направленных на совершенствование процесса производственной деятельности, экономических, правовых и социальных отношений в области науки, культуры, образования, в других сферах деятельности общества. Инновация считается осуществленной в том случае, если она внедрена на рынке или в производственном процессе. Соответственно различаются два типа технологических инноваций: продуктовые и процессные.
|
|
|
Продуктовые инновации охватывают внедрение новых или усовершенствованных продуктов. Процессные инновации – это освоение новой или значительно усовершенствованной продукции, организации производства. Выпуск такой продукции невозможен при использовании имеющегося оборудования или применяемых методов производства.
Инновационный процесс – это процесс преобразования научного знания в инновацию, который можно представить как последовательную цепь событий, в ходе которых инновация вызревает от идеи до конкретного продукта, технологии или услуги и распространяется при практическом использовании. В отличие от НТП инновационный процесс не заканчивается внедрением, т.е. первым появлением на рынке нового продукта, услуги или доведением до проектной мощности новой технологии. Этот процесс не прерывается и после внедрения, ибо по мере распространения (диффузии) новшество совершенствуется, делается более эффективным, приобретает ранее не известные потребительские свойства. Это открывает для него новые области применения и рынки, а следовательно, и новых потребителей, которые воспринимают данный продукт, технологию или услугу как новые именно для себя. Таким образом, этот процесс направлен на создание требуемых рынком продуктов, технологий или услуг и осуществляется в тесном единстве со средой: его направленность, темпы, цели зависят от социально-экономической среды, в которой он функционирует и развивается.
Например, стремительное инновационное развитие биотехнологий в области медицины вывело производства лекарств на совершенно новый уровень. Новая биотехнология расширила горизонты лекарственных средств, полученных методами химического синтеза, в фармацевтических биотехнологиях используются позволяющие создавать соединения составляющие основу препаратов (прежде всего белки), зачастую идентичные естественным. Результаты, полученные при исследовании структуры и функций генома или белков, подталкивают к открытию новых продуктов, позволяя при этом узнать еще больше про сам биологический процесс, который необходимо контролировать или изменить.
|
|
|
В настоящее время биотехнология является наиболее активной отраслью в области новых разработок. Объем продаж биотехнологических препаратов по всему миру в 2007 году составил 70 млрд дол., а его прирост по сравнению с 2006 годом – 15 %.
В соответствии с этим, инновация представляет собой конечный результат инновационной деятельности в области биотехнологии, получивший реализацию в виде нового или усовершенствованного продукта, реализуемого на рынке, нового или усовершенствованного биотехнологического процесса, используемого в практической деятельности. Следует отметить, что в среднем требуется от 10 до 15 лет и примерно 1,3 млрд дол. (включая стоимость неудач) для того, чтобы запустить новый продукт. Это достаточно долгий и трудоемкий процесс, включающий в себя несколько стадий. К примеру, проведение доклиническимх исследований на животных является обязательным при создании лекарственных средств. На этом этапе исследуются фармакодинамика и фармакокинетика веществ, устанавливаются их специфическая активность и безопасность, определяются оптимальные дозы и продолжительность использовнаия. На доклинической стадии особое внимание уделяется побочным эффектам, токсичности при однократном и многократном введении, аллергенности и т.д. На этой же стадии проводится разработка лекарственной формы будущего лекарственного средства для применения в ходе клинических испытаний на человеке.
Клинические исследования проходят четыре фазы. I фаза проводится с целью предварительной оценки безопасности исследуемого ЛС, наличия терапевтического действия, а также определения предполагаемой схемы дозирования путем изучения фармакокинетических параметров препарата.
II фаза клинических испытаний – первый опыт применения препарата у пациентов с заболеванием, для лечения которого он предназначен. Проводится с целью показать активность и оценить краткосрочную безопасность активного вещества у пациентов. В III фазе клинических испытаний на больших группах пациентов определяют краткосрочный и долгосрочный баланс безопасность/эффективность для лекарственных форм активного вещества, его общую и относительную терапевтическую ценность. Исследуются также профиль и разновидности наиболее часто встречающихся побочных реакций и специфические характеристики препарата. Процесс создания лекарственного препарата завершается его регистрацией и получением разрешения на маркетинг.
|
|
|
После выведения препарата на рынок продолжаются постмаркетинговые клинические исследования. Клинические испытания IV фазы позволяют получить данные для регистрации новых показаний, выявить нежелательные явления и побочные действия препарата при более длительном применении у различных групп пациентов при воздействии различных факторов риска, изучить особенности препарата в зависимости от расовой и генетической принадлежности.
В случае успешного завершения клинических испытаний следующим этапом внедрения препарата, например, в США, является запрос официального одобрения регуляторными органами, который оформляется в виде заявки на применение нового препарата (new drug application, NDA), либо в виде заявки на получение разрешения применения биопрепарата (biologics license application, BLA). Такие заявки могут занимать сотни или тысячи страниц и содержат подробную информацию о структуре продукта, его производстве, результатах лабораторного тестирования и клинических испытаний.
Каждый одобренный препарат получает официальную инструкцию стандартной формы, содержание которой FDA разрабатывает совместно с компанией, занимающейся маркетингом препарата. Инструкция содержит перечень официально одобренных показаний к применению, описание препарата, возможные побочные эффекты, рекомендуемую дозировку, краткое описание результатов клинических испытаний и другую информацию, которая может быть полезна лечащим врачам.
В связи с особенностями проведения клинических исследований так называемый «эффективный» период действия патента на инновационный биотехнологический препарат может быть значительно меньше обычных 17-20 лет. Дело в том, что патентование обычно проводится тогда, когда препарат находится на первой стадии клинических исследований. Прежде чем попасть на рынок, новое лекарственное средство должно пройти еще 2 этапа исследований и период утверждения регуляторными органами. А это может занять в общей сложности до 10 лет. К тому времени, как пациенты получат новое ЛС, останется меньше 10 лет патентной защиты. К 2012 году большинство запатентованных инновационных биотехнологических препаратов войдут в стадию выхода из-под патентной защиты, что приведет к резкому увеличению на рынке количества биодженериков.
|
|
|
Что касается классического жизненного цикла инновационного продукта, то он приведен на рисунке 1.
В заключение хотелось бы обозначить перспективы развития инновационных биотехнологических препаратов в РФ. Фундаментом для разработки и развития инноваций может послужить производство и вывод на рынок субстанций и готовых продуктов в области биотехнологий. Конечно, в условиях нынешней экономической ситуации для запуска и развития отечественных биотехнологических компаний в РФ потребуется сотрудничество и кооперация частного бизнеса и государства. Государственная поддержка развития, прежде всего, должна включать разработку стратегий долгосрочных программ развития, участие в софинансировании и помощь в процессе регистрации биотехнологий.
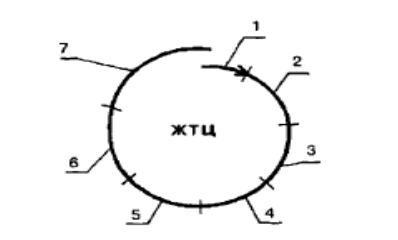
Рисунок 1 – Структура жизненного цикла товара*
* 1 – стратегический маркетинг; 2 – НИОКР; 3 – организационно-технологическая подготовка нового производства (ОТПП); 4 – производство; 5 – подготовка товара к функционированию; 6 – эксплуатация и ремонты; 7 – утилизация.
Конечно, как и любая другая наука, биотехнология не стоит на месте. Она развивается, причем стремительно, несмотря на строгий контроль над всеми направлениями работ, результаты которых теоретически могут нанести вред человеку. Быстрота развития биотехнологии обусловлена ее способностью помочь в решении множества проблем, с которыми в настоящее время сталкивается общество. В число таких задач входят излечение тяжелых заболеваний, повышение эффективности и безопасности сельскохозяйственного производства, очистка окружающей среды от загрязнений, сохранение биологического разнообразия и многое другое.
|
|
|


