 |
Лекция 15. Реальные газы. Фазовые равновесия и превращения
|
|
|
|
Лекция 15. Реальные газы. Фазовые равновесия и превращения
Реальные газы. Молекулярные силы. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса и экспериментальные изотермы реальных газов. Внутренняя энергия реального газа. Эффект Джоуля-Томсона. Фазы и фазовые превращения. Условия равновесия фаз. Фазовые диаграммы. Уравнение Клапейрона-Клаузиуса. Метастабильные состояния. Критическая точка. Тройная точка. Фазовые переходы 1-го и 2-го рода.
15. 1. Реальные газы. Молекулярные силы. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса и экспериментальны изотермы реальных газов
 Как известно атомы содержат положительно заряженные ядра и электронную оболочку (электронное облако). Размеры ядер очень малы ~10-15 - 10-14м. Радиус орбиты электрона составляет порядка ~10-10 м=1
Как известно атомы содержат положительно заряженные ядра и электронную оболочку (электронное облако). Размеры ядер очень малы ~10-15 - 10-14м. Радиус орбиты электрона составляет порядка ~10-10 м=1 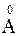 . При сближении молекул до расстояния около двух - трех диаметров (3
. При сближении молекул до расстояния около двух - трех диаметров (3 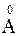 ) начинают проявляться взаимодействие зарядов ядер и электронных оболочек.
) начинают проявляться взаимодействие зарядов ядер и электронных оболочек.
Прежде всего, при сближении начинают проявляться силы притяжения F< 0 (рис. 15. 1).
Однако когда молекулы подойдут " вплотную" друг к другу и " соприкасаются" своими оболочками, то дальнейшее их сближение затрудняется. Между электронными оболочками возникнут огромные силы отталкивания, резко возрастающие по мере дальнейшего проникновения оболочек друг в друга. Начинают преобладать силы отталкивания F> 0. На нижнем графике дана зависимость потенциальной энергии взаимодействия молекул от расстояния между их центрами U(r). Когда результирующая сила межмолекулярного взаимодействия равна нулю (при r=r0) потенциальная энергия минимальна, Wp min< 0, т. е. для удаления молекул друг от друга необходимо, чтобы внешние силы, совершили работу.
|
|
|
Между тремя основными агрегатными состояниями имеется значительное расхождение в величине энергии межмолекулярного взаимодействия. Так, например, для:
1) газов кТ> > Wp min;
2) кристаллических твердых тел кТ< < Wp min;
3) жидкостей кТ»Wp min.
Движение молекул и структура вещества существенно зависят от соотношения энергии теплового движения и потенциальной энергии взаимодействия между молекулами.
Если моль газа находится при нормальных условиях (p@105, T»300К), то молекулы настолько удалены друг от друга, что их взаимодействием можно пренебречь, можно пренебречь также и их линейными размерами. Поэтому для этих условий хорошо выполняется уравнение состояния идеального газа, уравнение Менделеева - Клапейрона
 . (15. 1)
. (15. 1)
 Однако при высоких давлениях и низких температурах молекулы настолько сближаются, что уже нельзя пренебречь их взаимодействием и их собственными размерами. Поэтому в уравнение (15. 1) необходимо ввести поправки на " собственный" объем молекул и дополнительное внутреннее давление, которое обусловлено взаимодействием молекул.
Однако при высоких давлениях и низких температурах молекулы настолько сближаются, что уже нельзя пренебречь их взаимодействием и их собственными размерами. Поэтому в уравнение (15. 1) необходимо ввести поправки на " собственный" объем молекул и дополнительное внутреннее давление, которое обусловлено взаимодействием молекул.
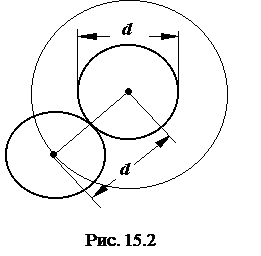
Поправку на собственный объем молекул можно ввести из следующих соображений. Очевидно, молекула не может находиться в тех местах, где размещены остальные N-1 молекула. Для каждой пары взаимодействующих молекул недоступной является та часть объема, в которой расстояние между их центрами равно d, т. е. сфера радиуса d (рис. 15. 2), объем которой составляет (4/3)pd3, для всех молекул недоступным является объем  .
.
Сомножитель 1/2 появился вследствие того, что при парном взаимодействии недоступным считается объем, образованный половиной (N/2) молекул. Итак, поправка на недоступный (" собственный" ) объем составляет  , т. е. недоступный объем равен учетверенному объему всех молекул газа в сосуде. Таким образом, поправка на собственный объем молекул
, т. е. недоступный объем равен учетверенному объему всех молекул газа в сосуде. Таким образом, поправка на собственный объем молекул  , где
, где  - суммарный собственный объем молекул газа, уравнение состояния реального газа можно записать так (для моля или киломоля)
- суммарный собственный объем молекул газа, уравнение состояния реального газа можно записать так (для моля или киломоля)
|
|
|
 . (15. 2)
. (15. 2)
 Силы межмолекулярного взаимодействия, силы притяжения, проявляются при условии достаточного сближения молекул. Следовательно, в уравнение состояния реального газа необходимо ввести о так называемую поправку " на внутреннее давление", которое обуславливают силы межмолекулярного взаимодействия. Поправка на " внутреннее давление" в уравнении состояния реального газа, вводится из следующих соображений. Пусть молекулы окружают воображаемую плоскую пластинку, как это показано на рис. 15. 3. Естественно считать, что f1 - сила, действующая на данную молекулу со стороны молекул, находящихся справа от пластины f1~n. Где n -концентрация молекул справа от стенки. Тогда дополнительное давление со стороны молекул слева от пластины будет пропорционально концентрации молекул слева от нее, т. е.
Силы межмолекулярного взаимодействия, силы притяжения, проявляются при условии достаточного сближения молекул. Следовательно, в уравнение состояния реального газа необходимо ввести о так называемую поправку " на внутреннее давление", которое обуславливают силы межмолекулярного взаимодействия. Поправка на " внутреннее давление" в уравнении состояния реального газа, вводится из следующих соображений. Пусть молекулы окружают воображаемую плоскую пластинку, как это показано на рис. 15. 3. Естественно считать, что f1 - сила, действующая на данную молекулу со стороны молекул, находящихся справа от пластины f1~n. Где n -концентрация молекул справа от стенки. Тогда дополнительное давление со стороны молекул слева от пластины будет пропорционально концентрации молекул слева от нее, т. е. 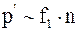 Поэтому, дополнительное давление
Поэтому, дополнительное давление  . С учетом сказанного можно записать
. С учетом сказанного можно записать  , где " а" зависит от конкретного вида молекул, т. е. газа.
, где " а" зависит от конкретного вида молекул, т. е. газа.
Ударяющиеся о стенку сосуда, в котором находится газ, молекулы, притягиваются остальными молекулами, следовательно, давление газа на стенки сосуда уменьшается на некоторую среднюю величину p' (давление p' иногда называют внутренним давлением).
Вводя в уравнение (15. 2) поправку на внутреннее давление, будем иметь
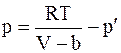 ;
; 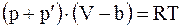 ;
; 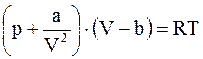 . (15. 3)
. (15. 3)
Уравнение (15. 3) - уравнение состояния моля или киломоля реального газа, уравнение Ван-дер-Ваальса.
Для произвольной массы газа его можно записать в следующем виде
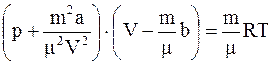 . (15. 4)
. (15. 4)
Это уравнение представляет собой уравнение 3ей степени относительно объема V
 . (15. 5)
. (15. 5)
Следовательно, при данных значениях p и Т, известных значениях a и b оно имеет три решения (V1< V2< V3). При этом корни уравнения либо все три вещественные, либо один вещественный и два мнимых (комплексно сопряженных), не имеющих физического смысла.
Задавая различные значения p, решая уравнение Ван-дер-Ваальса для нескольких избранных, но постоянных значений температуры газа T, можно построить семейство изотерм Ван-дер-Ваальса, представленных на рис. 15. 4.
|
|
|
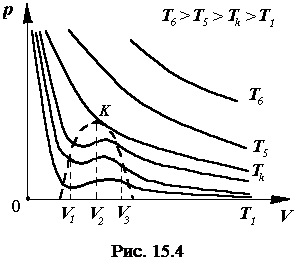 При высоких температурах (T> Tk) поправка
При высоких температурах (T> Tk) поправка  мало по сравнению с p и этой поправкой можно пренебречь. К тому же если собственный объем молекул мал по сравнению с объемом, занимаемым газом (b< < V), то уравнение Ван-дер-Ваальса имеет один вещественный корень и переходит в уравнение Менделеева. -Клапейрона, справедливое для идеальных газов. При высоких температурах изотермы Ван-дер-Ваальса имеют вид изотерм pV = const и характеризуют газообразное состояние вещества.
мало по сравнению с p и этой поправкой можно пренебречь. К тому же если собственный объем молекул мал по сравнению с объемом, занимаемым газом (b< < V), то уравнение Ван-дер-Ваальса имеет один вещественный корень и переходит в уравнение Менделеева. -Клапейрона, справедливое для идеальных газов. При высоких температурах изотермы Ван-дер-Ваальса имеют вид изотерм pV = const и характеризуют газообразное состояние вещества.
При уменьшении температуры форма изотерм изменяется и при некотором значении T = Tк, изотермы имеют точку перегиба " К".
В области T< Tk имеется интервал давлений, в котором уравнение (15. 3) имеет три вещественных корня. Наибольший корень V3 соответствует наименьшей плотности вещества и относится к газовому состоянию. Наименьший корень V1 к наиболее плотному бесструктурному состоянию, т. е. к жидкости. Средний корень V2, приходящийся на восходящую ветвь изотермы, соответствует неустойчивому, а поэтому практически ненаблюдаемому состоянию. Действительно, любое флуктуационное изменение объема V2 влечет за собой такое изменение давления газа, при котором точка изотермы, характеризующая его состояние, неизбежно переходит с восходящей ветви кривой на нисходящую ветвь. В точке K на изотерме Tk все три корня уравнения Ван-дер-Ваальса вещественны и равны (V1=V2=V3=Vk). Такое состояние газа называется критическим и, ему соответствуют определенные значения pk, Vk, Tk. Так как, согласно теореме Безу (V – Vk)3 = 0, то из сравнения коэффициентов при соответствующих степенях в (15. 5) получим
 (15. 6)
(15. 6)
Откуда
 или
или  . (15. 7)
. (15. 7)
Таким образом, по экспериментально найденным значениям Vk и Tk, для данной массы вещества, из системы уравнений (15. 7) можно определить параметры газа " a" и " b" и значение pk. По известным " a", " b" и R – критические параметры газа (pk, Tk и соответствующий массе газа объем Vk).
В табл. 15. 1 приведены значения pk и Tk для некоторых жидкостей. Как видно, критическая температура приблизительно в 1, 5 раза превышает температуру кипения жидкости при нормальном внешнем давлении.
|
|
|
|
|
|


