 |
15.5. Уравнение Клапейрона-Клаузиуса. Метастабильные состояния. Критическая точка
|
|
|
|
Переход вещества из одной фазы в другую всегда связан с выделением или поглощением некоторого количества тепла – так называемой скрытой теплоты, или теплоты перехода. В случае перехода жидкости в пар говорят о теплоте парообразования, в случае перехода твердого тела в жидкость – о теплоте плавления. Так как фазовый переход происходит при постоянном давлении, то теплота перехода q12 из фазы 1 в фазу 2 равна разности тепловых функций Q1 и Q2. Тепловые функции, на основании первого начала термодинамики, представляют собой количество тепла подводимого или отобранного от системы в процессе ее перехода из состояния в состояние и равны сумме изменения внутренней энергии системы и работы, которую может совершить либо сама система, либо совершается над системой. Иногда их называют теплосодержанием или энтальпией. Таким образом,
 . (15. 27)
. (15. 27)
Из (15. 27) видно, что q12 = - q21, т. е. если при некотором фазовом переходе теплота поглощается, то обратный переход сопровождается выделением тепла.
Существует общее правило, согласно которому фазовый переход, происходящий при нагревании, всегда сопровождается поглощением тепла (плавление твердых тел, испарение). Это связано с тем, что нагревание стимулирует процессы, сопровождающиеся поглощением тепла и тем самым как бы противодействующие внешнему воздействию (принцип Ле Шателье).
С помощью принципа Ле Шателье можно связать направление кривой фазового равновесия в координатах p, T (рис. 15. 7) с изменением объема при фазовом переходе.
Например, если равновесная система из жидкости и пара подвергается сжатию, так что давление в ней повышается, то в системе должны произойти процессы, уменьшающие объем вещества и тем самым ослабляющие влияние сжатия. Для этого должна произойти конденсация пара, поскольку переход пара в жидкость всегда сопровождается уменьшением объема. Это означает, что смещение вверх по кривой равновесия (рис. 15. 7) приводит в область жидкой фазы. Жидкость в данном случае является " низкотемпературной" фазой, т. е. фазой существующей при более низких температурах.
|
|
|
Следовательно, температура перехода должна возрастать с увеличением давления.
Такой характер зависимости температуры перехода от давления имеет место всегда, когда переход в " высокотемпературную" фазу сопровождается увеличением объема. При плавлении большинства твердых веществ объем вещества возрастает, а температура плавления возрастает с увеличением давления. Исключение составляют лед, чугун и висмут. У этих веществ плавление сопровождается уменьшением объема и понижением температуры плавления при увеличении объема.
Эти качественные выводы находят свое количественное отражение в формуле, связывающей наклон кривой фазового равновесия с теплотой перехода и изменением объема при переходе. Эта формула называется уравнением (формулой) Клапейрона-Клаузиуса
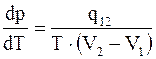 или
или 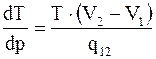 , (15. 28)
, (15. 28)
где q12, V1, V2 – теплота перехода и объемы фаз, отнесенные к одному и тому же количеству вещества.
Из (15. 28) видно, что производная 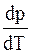 обратно пропорциональна
обратно пропорциональна  . Поскольку изменение объема при испарении велико, а при плавлении мало, то кривые плавления идут гораздо круче кривых испарения.
. Поскольку изменение объема при испарении велико, а при плавлении мало, то кривые плавления идут гораздо круче кривых испарения.
Кроме того, уравнение Клапейрона-Клаузиуса определяет температуру и теплоту фазового перехода при бесконечно малом изменении давления:
 ;
; 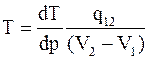 , (15. 29)
, (15. 29)
где q12 - теплота фазового перехода;
T - температура перехода;
dp/dT - производная от давления по температуре;
dT/dp - производная от температуре по давлению/
|
|
|
Пар, находящийся в равновесии со своей жидкостью, называется насыщенным, а о его давлении говорят как об упругости насыщенного пара. Кривую равновесия жидкость – пар (рис. 15. 7) можно рассматривать и как кривую зависимости упругости от температуры. Упругость насыщенного пара возрастает с увеличением температуры.
При достаточно низких температурах плотность насыщенного пара понижается настолько, что он приобретает свойства идеального газа. В этом случае температурная зависимость упругости пара определяется по формуле (она может быть выведена из уравнения Кларейрона-Клаузиуса)
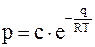 , (15. 30)
, (15. 30)
где c – постоянный коэффициент;
q – удельная теплота испарения (например, молярная);
R – универсальная газовая постоянная;
T – температура пара.
Происхождение этой экспоненциальной зависимости можно понять из следующих соображений. Молекулы в жидкости связаны между собой силами притяжения, для преодоления которых и перехода какой-либо молекулы из жидкости в пар надо совершить определенную работу. Можно утверждать, что потенциальная энергия молекулы в жидкости меньше ее потенциальной энергии в паре на величину, равную теплоте испарения, отнесенной к одной молекуле. Эта разность потенциальных энергий равна q/NА, где q – молярная теплота испарения; NА – число Авогадро.
По отношению qисп/NА можно оценить величину ван-дер-ваальсовых сил, действующих между молекулами. Это отношение является величиной, являющейся мерой глубины минимума на кривой Ван дер Ваальсова взаимодействия. Таким способом, например, для гелия получили величину равную одной сотой электрон-вольта (~0, 01 эВ).
Одновременное существование термодинамически равновесных фаз в многофазной системе называют фазовым равновесием. Для фазового равновесия справедливо правило фаз Гиббса - в веществе, состоящем из n компонентов, одновременно может существовать не более чем (n + 2) равновесных фаз. При этом число физических параметров системы, которые можно изменять, не нарушая фазовое равновесие:
L = n + 2 - j, (15. 31)
где j - число фаз, находящихся в равновесии.
В обычных условиях над поверхностью жидкости находится, помимо ее собственного пара, также и посторонний газ – воздух. Это обстоятельство мало сказывается на самом фазовом равновесии: испарение продолжается до тех пор, пока парциальное давление пара не станет равным упругости насыщенного пара при температуре жидкости. Наличие атмосферы, однако, существенно влияет на ход процесса испарения. Процесс зависит от того, будет ли упругость насыщенного пара при данной температуре меньше или больше общего давления, под которым находится жидкость.
|
|
|
Если упругость меньше, то происходит сравнительно медленное испарение жидкости. Правда, непосредственно над жидкостью парциальное давление пара почти сразу равно упругости насыщенного пара. Этот насыщенный пар медленно (за счет диффузии) распространяется в окружающее пространство, и только по мере его перемешивания с воздухом испаряются новые порции жидкости. Скорость испарения можно увеличить, искусственно сдувая пар с поверхности жидкости.
Характер процесса существенно изменяется при условии, когда упругость насыщенного пара достигает (или несколько превысит) давления окружающей атмосферы – возникает бурное кипение жидкости. Оно характеризуется образованием газовых пузырьков у поверхности сосуда, растущих за счет испарения жидкости внутрь этих пузырьков и затем отрывающихся и поднимающихся через жидкость, перемешивая ее. При этом от свободной поверхности жидкости распространяется в окружающую атмосферу струя пара.
Превращение жидкости в пар не может происходить путем " самозарождения" пузырьков пара в толще чистой жидкости. Центрами образования газовой фазы являются мельчайшие пузырьки посторонних газов. Они существуют на стенках сосуда, образуются на изгоняемых при нагревании из жидкости растворенных в ней газов (или на взвешенных в жидкости пылинках). До достижения точки кипения (когда упругость насыщенного пара становится равной внешнему давлению) давление окружающей жидкости препятствует росту этих пузырьков.
Путем тщательной предварительной очистки и обезгаживания жидкости и стенок сосуда можно добиться практического отсутствия центров парообразования (центры образования могут уничтожаться и в процессе самого кипения). Это приводит к перегреву жидкости, остающейся жидкой при температурах выше точки кипения. Чтобы избежать перегрева жидкости и обеспечить наступление кипения, вводят в сосуд с жидкостью искусственные источники центров парообразования (пористые тела и другие примеси).
|
|
|
Перегретая жидкость (жидкость, существующая при температурах, характерных для газообразного состояния при данном давлении) представляет собой пример метастабильного состояния.
Метастабильное состояние - состояние неустойчивого равновесия физической макроскопической системы (фазы). В таком состоянии система может находиться длительное время, не переходя в более устойчивое (при данных условиях) состояние (фазу). Однако метастабильное состояние легко нарушается, и тогда вещество переходит в другое, устойчивое состояние. Так, перегретая жидкость мгновенно закипает при внесении в нее центров парообразования.
Аналогичные явления наблюдаются и при обратном процессе – конденсации пара. Осуществление фазового перехода в этом случае (в отсутствие соприкасающейся с паром жидкости) требует наличия в паре центров конденсации. Роль центров конденсации обычно играют мельчайшие посторонние включения. В связи с этим возможно переохлаждение (пересыщение) пара – доведение его до состояний с давлением, превышающим упругость насыщенного пара (при данной температуре). Такие состояния могут быть достигнуты, например, при охлаждении тщательно очищенного насыщенного пара путем его адиабатического расширения.
|
|
|


