 |
Теория кристаллического поля.
|
|
|
|
С 41. Теория кристаллического поля пришла на смену ТВС в 40-х годах XX столетия. В чистом виде она сейчас не применяется, так как
1) не может объяснить образование ковалентных связей в КС
2) и совершенно не учитывает истинного состояния лигандов (например, их действительных размеров) даже в случае взаимодействий, близких к чисто электростатическим.
Уже с середины 50-х годов упрощенная ТКП была заменена усовершенствованной теорией поля лигандов, учитывающей ковалентный характер химических связей между комплексообразователем и лигандом.
Однако наиболее общий подход к объяснению образования комплексных соединений дает теория молекулярных орбиталей (МО), которая в настоящее время превалирует над всеми остальными.
ММО предусматривает и чисто электростатическое взаимодействие при отсутствии перекрывания атомных орбиталей, и всю совокупность промежуточных степеней перекрывания.
С 42,43. Рассмотрим основные понятия ТКП, которая, как и ТВС, все еще сохраняет свое значение для качественного описания химических связей в комплексных соединениях из-за большой простоты и наглядности.
● В ТКП химическая связь комплексообразователь – лиганд считается электростатической. В соответствии с этой теорией
● лиганды располагаются вокруг комплексообразователя в вершинах правильных многогранников (полиэдров) в виде точечных зарядов.
● Реальный объем лиганда теорией во внимание не принимается.
● Лиганды, как точечные заряды, создают вокруг комплексообразователя электростатическое поле (“кристаллическое поле”, если рассматривать кристалл комплексного соединения, или поле лигандов), в котором энергетические уровни комплексообразователя и прежде всего d - подуровни расщепляются, и их энергия изменяется.
|
|
|
●Характер расщепления, энергия новых энергетических уровней зависит от симметрии расположения лигандов (октаэдрическое,
тетраэдрическое,
.плоскоквадратное кристаллическое поле).
● Когда в качестве лигандов координируются молекулы H2O, NH3, CO и другие, их рассматривают как диполи, ориентированные отрицательным зарядом к комплексообразователю.
С 44,45. Рассмотрим случай октаэдрического расположения лигандов (например, [CoF6]3- или [Co(NH3)6]3+). В центре октаэдра находится атом-комплексообразователь М(+n) с электронами на d -атомных орбиталях, а в его вершинах – лиганды в виде точечных отрицательных зарядов (например, ионы F- или полярные молекулы типа NH3). В условном ионе Ме(+n), не связанном с лигандами, энергии всех пяти d -АО одинаковы (т.е. атомные орбитали вырожденные).
С 46.. В октаэдрическом поле лигандов d -АО Ме комплексооб разователя попадают в неравноценное положение.
АО d (z 2) и d (x 2- y 2), вытянутые вдоль осей координат, ближе всего подходят к лигандам. Между этими орбиталями и лигандами, находящимися в вершинах октаэдра, возникают значительные силы отталкивания, приводящие к увеличению энергии орбиталей. Иначе говоря, данные АО металла подвергаются максимальному воздействию поля лигандов. Физической моделью такого взаимодействия может служить сильно сжатая пружина.


С 47. Другие три d -АО – d (xy), d (xz) и d (yz), расположенные между осями координат и между лигандами, находятся на более значительном расстоянии от L. Взаимодействие таких d -АО с лигандами минимально, а следовательно – энергия d (xy), d (xz) и d (yz)-АО понижается по сравнению с исходной.


С 48. Таким образом, пятикратно вырожденные d -АО комплексообразователя, попадая в октаэдрическое поле лигандов, подвергаются расщеплению на 2 группы новых орбиталей –
-трехкратно вырожденные орбитали с более низкой энергией, d(xy), d(xz) и d(yz),
|
|
|
- двукратно вырожденные орбитали с более высокой энергией, d (z 2) и d (x 2- y 2). Эти новые группы d -орбиталей с более низкой и более высокой энергией обозначают d e и d g:
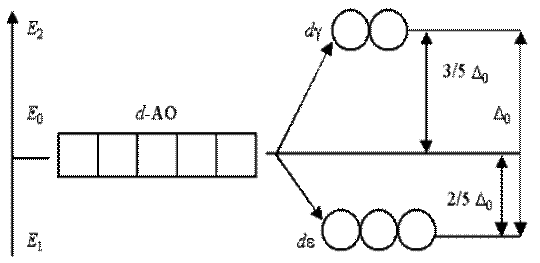
Разность энергий двух новых подуровней d e и d g получила название параметра расщепления D0:
E 2g – E 1e = Е 0D0
Расположение двух новых энергетических подуровней d e и d g по отношению к исходному (d -АО) на энергетической диаграмме несимметричное:
(Е 2 g – Е 0) > (Е 0 – Е 1e).
С 49. Квантово-механическая теория требует, чтобы при полном заселении новых энергетических уровней электронами общая энергия осталась без изменения, т.е. она должна остаться равной Е 0.
Иначе говоря, должно выполняться равенство
4е∙(Е 2g – Е 0) = 6е∙(Е 0 – Е 1e),
где 4 и 6 – максимальное число электронов на d g - и d e -АО. Из этого равенства следует, что
(Е 2g – Е 0)/(Е 0 – Е 1e)=6е/4е=3АО/2АО и
(Е 2g – Е 1e) / (Е 0 – Е 1e>) = 5АО/2АО, или
D0 / (Е 0 – Е 1e) = 5АО/2АО, откуда (Е 0 – Е 1e) = 2АО/5АО ´ D0.
Размещение каждого электрона из шести максимально возможных на d e -орбитали вызывает уменьшение (выигрыш) энергии на 2/5 D0 = 0,4D0
Наоборот, размещение каждого электрона из четырех возможных на d g -орбитали вызывает увеличение (затрату) энергии на 3/5 D0 = 0,6D0
Если заселить электронами d e- и d g-орбитали полностью, то никакого выигрыша энергии не будет (как не будет и дополнительной затраты энергии):
4е ´ 3/5 ´ D0 - 6е ´ 2/5 ´ D0 =0или 4е ´ 0,6 ´ D0 - 6е ´ 0,4 ´ D0 = 0
С 49, 50. Но если исходная d -АО заселена только частично и содержит от 1 до 6 электронов, и эти электроны размещаются только на d e-АО, то мы получим значительный выигрыш энергии. Выигрыш энергии за счет преимущественного заселения электронами d e-атомных орбиталей называют энергией стабилизации комплекса полем лигандов ЭСКП.
С 51. Специфика каждого из лигандов сказывается в том, какое поле данный лиганд создает – сильное или слабое. Чем сильнее поле лигандов, тем больше значение параметра расщепления D0.
Параметр расщепления Δ зависит:
-от размеров центрального иона комплексообразователя,
-его заряда,
-электронной конфигурации и
-от природы лиганда
С 52. Изучение параметра расщепления, основано на спектроскопических исследованиях. Длины волн полос поглощения комплексов l в кристаллическом состоянии или в растворе, обусловленные переходом электронов с d e- на d g-АО, связаны с параметром расщепления D0 следующим образом:
|
|
|
n = 1 / l; D0 = Е 2g – Е 1e = h ´ n = h ´ (c / l) = h ´ c ´ n, где
h постоянная Планка равна 6,626 ´ 10-34 Дж . с;
с = 3 ´ 108 м/с скорость света.
единица измерения D0 – та же, что у волнового числа n: 1см-1, что приближенно отвечает 12 Дж/моль.
В КС, включающих комплексообразователи одного и того же периода и в одинаковой степени окисления, с одними и теми же лигандами, параметр расщепления примерно одинаков. С ростом степени окисления комплексообразователя значение D0 увеличивается. Так, для аквакомплексов [Mn(H2O)6]2+ и [Fe(H2O)6]2+ значение параметра расщепления составляет 7800 и 10400 см-1, а для [Mn(H2O)6]3+ и [Fe(H2O)6]3+ - 13700 и 21000 см-1 соответственно.
При увеличении заряда ядра атома-комплексообразователя D0 тоже растет. Катионы гексаамминкобальта(III) [Co(NH3)6]3+, гексаамминродия(III) [Rh(NH3)6]3+, гексаамминиридия(III) [Ir(NH3)6]3+ (Z = 27, 45 и 77) характеризуются параметрами расщепления, равными 22900, 34100 и 41000 см-1.
С 51. Зависимость D0 от природы лигандов более разнообразна. В результате исследования многочисленных комплексных соединений было установлено, что по способности увеличивать параметр расщепления металлов - комплексообразователей, находящихся в своих обычных степенях окисления, наиболее распространенные лиганды можно расположить в следующий спектрохимический ряд, вдоль которого значение D0 монотонно растет:
I- < Br- < Cl-» NCS- < < NO3- < F- < OH- < H2O» H- < NH3 < NO2- < CN-» NO» CO.
Таким образом, наиболее сильное электростатическое поле вокруг комплексообразователя и самое сильное расщепление d -АО вызывают лиганды NO2-, CN- и CO.
В октаэдрических комплексах, образуемых ионами с электронными конфигурациями d4, d5, d6, d7, возможно различное размещение электронов – либо высоко -, либо низкоспиновое в зависимости от параметра расщепления Δ и энергии спин спаривания P.
|
|
|


