 |
Энергия спин спаривания Р определяется как разность Еэнергий межэлектронного взаимодействия низкоспиновой (НС) и Евысокоспиновой (ВС) конфигураций, деленная на число спаривающихся электронов.
|
|
|
|
Очевидно, что
низкоспиновое состояние реализуется тогда, когда Pсп.сп. < Δ0,
а высокоспиновое – когда Pсп.сп. > Δ0
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
В рамках ТКП высокоспиновый комплекс  с электронной конфигурацией
с электронной конфигурацией 
 будет менее устойчив (ЭСКП = 0,4Δ), чем низкоспиновый
будет менее устойчив (ЭСКП = 0,4Δ), чем низкоспиновый  (электронная конфигурация
(электронная конфигурация  ЭСКП = 2,4
ЭСКП = 2,4  ).
).
Распределение электронов между нижним (dγ) и верхним (dε) уровнями в тетраэдрических комплексах также зависит от соотношения Δ и P, но поскольку Δтетр < Δокт, тетраэдрические комплексы обычно остаются высокоспиновыми.
С 50, 51, 53. Рассмотрим распределение электронов по d e- и d g-орбиталям в октаэдрическом поле лигандов. Заселение d e- и d g-орбиталей происходит в полном соответствии с правилом Гунда и принципом Паули. При этом независимо от значения параметра расщепления первые три электрона занимают квантовые ячейки d e-подуровня:
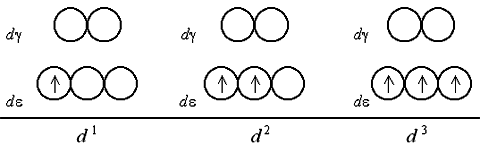
● Если число электронов на d -подуровне комплексообразователя больше трех, для размещения их по расщепленным подуровням появляется две возможности. При низком значении параметра расщепления (слабое поле лигандов) электроны преодолевают энергетический барьер, разделяющий d e- и d g-орбитали; четвертый, а затем и пятый электроны заселяют квантовые ячейки d g-подуровня. При сильном поле лигандов и высоком значении D0 заселение четвертым и пятым электроном d g-подуровня исключено; происходит заполнение d e-орбиталей.
|
|
|
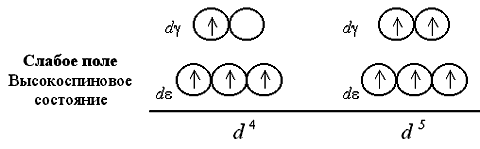
При слабом поле лигандов заселяющие квантовые ячейки 4 или 5 электронов имеют параллельные спины, поэтому получаемый комплекс оказывается сильно парамагнитен. В сильном поле лигандов образуются одна, а затем две электронные пары на d e-подуровне, так что парамагнетизм комплекса оказывается гораздо слабее.

Шестой, седьмой и восьмой электроны в случае слабого поля оказываются снова на d e-подуровне, дополняя конфигурации до электронных пар (одной в случае d 6, двух – d 7 и трех – d 8):

В случае сильного поля лигандов шестой электрон заселяет d e-АО, приводя к диамагнетизму комплекса, после чего седьмой и восьмой электроны поступают на d g-подуровень:
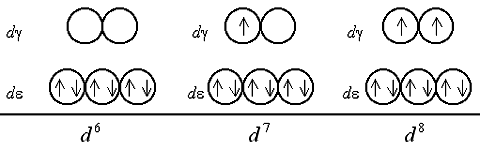
Очевидно, при восьмиэлектронной конфигурации различия в строении между комплексами с лигандами слабого и сильного поля исчезают. Заселение орбиталей девятым и десятым электроном также не различается для комплексов обоих типов:

Вернемся к рассмотрению электронного строения октаэдрических комплексных ионов [Co(NH3)6]3+ и [CoF6]3-. В соответствии с расположением в спектрохимическом ряду, аммиак NH3 относится к числу лигандов сильного поля, а фторид-ион F- – слабого поля. Следовательно, заселение электронами атомных орбиталей в данных комплексах будет происходит по схеме:

В анионе [CoF6]3- лиганды F- создают слабое кристаллическое поле (D 0 = 13000 см-1), и все электроны исходной 3 d 6-АО размещаются на d e- и d g-орбиталях без какого-либо спаривания. Комплексный ион является высокоспиновым и содержит четыре неспаренных электрона, поэтому он парамагнитен.

В ионе [Co(NH3)6]3+ лиганды NH3 создают сильное кристаллическое поле (D0 = 22900 см-1), все 3 d 6-электроны размещаются на более энергетически выгодной d e-орбитали. Переход электронов с d e- на d g-орбитали невозможен из-за слишком высокого энергетического барьера. Поэтому данный комплексный катион является низкоспиновым, он не содержит неспаренных электронов и диамагнитен.
|
|
|
С 44. Аналогичным образом могут быть представлены схемы распределения электронов по орбиталям в октаэдрическом поле для ионов[Fe(H2O)6]2+ и [Fe(CN)6]4-:


Лиганды H2O создают слабое поле; обмен электронами между d e- и d g-орбиталями не вызывает затруднений и поэтому число неспаренных электронов в комплексном ионе такое же, как и в условном ионе Fe+II. Получаемый аквакомплекс – высокоспиновый, парамагнитный.
Наоборот, лиганды CN- вызывают значительное расщепление d -АО, составляющее 33000 см-1. Это значит, что существует сильная тенденция к размещению всех электронов на d e-орбиталях. Выигрыш энергии, получаемый при таком заселении орбиталей, много больше энергетических затрат, обусловленных спариванием электронов.
|
|
|







