 |
Ю. И. Шумяцкий. Адсорбционные процессы. Учебное пособие. Москва, 2005. Предисловие
|
|
|
|
Министерство образования и науки России
Российский химико-технологический университет им. Д. И. Менделеева
Ю. И. Шумяцкий
АДСОРБЦИОННЫЕ ПРОЦЕССЫ
Учебное пособие
Москва, 2005
Предисловие
Учебное пособие предназначено для студентов специальности 251800 «Основные процессы химических производств и химической кибернетики» (специализация 251802 «Мембранные технологии»). В нем описываются процессы очистки и разделения газовых и жидких сред твердыми материалами - адсорбентами, поглощающими молекулы нежелательных веществ. Материал пособия входит в более широкий курс «Сорбционные процессы», который предусматривает изучение, наряду с адсорбционными процессами, процессов ионообменных, основанных на применении веществ, поглощающих ионы, – ионитов.
Курс «Сорбционные процессы» и его раздел «Адсорбционные процессы» введен для расширения образовательного базиса студентов и углубления их знаний в области диффузионных явлений и технологий, смежных с мембранной очисткой и разделением газов и жидкостей.
Пособие состоит из двух разделов: «Физико-химические и инженерные основы адсорбционных процессов» и «Технология адсорбционных процессов». В области инженерной теории адсорбции и в технологии адсорбционных процессов в последние десятилетия произошли большие изменения. Отражение этих изменений на уровне учебного курса, по мнению автора, представляет большой интерес; оно и было осуществлено в пособии.
Материал пособия изложен на познавательном уровне. Как правило, в нем рассматриваются принципиальные вопросы, а именно: с помощью какого процесса можно решить некоторую практическую задачу, какой адсорбент должен быть применен для ее осуществления, какие операции надо провести, чтобы обеспечить достижение поставленной цели? Это главные вопросы прикладной адсорбции и с ответа на них начинается проектирование
|
|
|
В области технической адсорбции имеется несколько хороших книг. К ним относятся учебное пособие Е. Н. Серпионовой «Промышленная адсорбция газов и паров», М., 1969 и монография Н. В. Кельцева «Основы адсорбционной техники», М., 1984. Автор использовал их в своей работе. Специфика этого пособия состоит в отражении того нового теоретического и прикладного материала, о котором говорилось выше, и в попытке рассмотреть совокупность адсорбционных процессов как некоторое единство взаимосвязанных элементов – процессов.
Автор благодарит заведующего кафедрой «Мембранные технологии», профессора Г. Г. Каграманова, при поддержке которого был введен курс и написано пособие.
1. Физико-химические и инженерные основы адсорбционных процессов
1. 1. Основные термины и определения
Адсорбент – твердое тело, используемое в качестве средства очистки (разделения).
Адсорбтив (синоним: адсорбат) – вещество, подлежащее удалению для достижения эффекта очистки (разделения).
Объемная фаза (синонимы: поток, среда) – среда, подвергаемая очистке (разделению). Она представляет собой жидкость или газ.
Адсорбционный процесс заключается в приведении в контакт объемной фазы и адсорбента, в ходе которого нежелательные молекулы объемной фазы поглощаются адсорбентом, а объемная фаза становится чистой.
Это краткое описание процесса адсорбционной очистки предполагает, что подвергаемая очистке объемная фаза представляет собой смесь компонентов, один (одни) из которых поглощается лучше, чем другой (другие). Различия в адсорбируемости компонентов вытекают из различий в свойствах, строении и структуре молекул объемной фазы, взаимодействующих с адсорбентом. Свое проявление эти различия находят в адсорбционной емкости (синонимы: адсорбционная активность, величина адсорбции, концентрация адсорбата в адсорбенте), которая характеризует способность единичной массы (объема) адсорбента поглощать компоненты очищаемой среды. В работах академического плана адсорбционную активность выражают в виде числа молей адсорбата, поглощаемых 1 г адсорбента, что соответствует размерности моль/г. В технологических исследованиях чаще используют размерность г/100 г, указывая массу адсорбата, поглощенного 100 г чистого адсорбента. (Часто этот способ выражения адсорбционной емкости называют весовым процентом). Для технологических расчетов самой удобной размерностью емкости является г/м3, т. е. масса поглощенного адсорбата, отнесенная к единице объема адсорбента.
|
|
|
Концентрацию вещества в объемной фазе выражают через массу вещества, находящуюся в единице объема среды, г/м3. Другие способы выражения содержания вещества в объемной фазе – это единицы давления, весовая и объемная доли.
Обозначим величину адсорбции через Х, концентрацию в объемной фазе – через С. Для предпочтительных размерностей, указанных выше, отношение переменных (К = Х/С) равно формально безразмерной величине, которую будем назвать коэффициентом распределения адсорбата. В системах адсорбент - адсорбат коэффициент распределения зависит от типа системы и условий, в которых она находиться; он лежит в пределах 101- 106 и выше. Отношение коэффициентов распределения двух адсорбатов, находящихся в смеси, называют коэффициентом разделения. Можно показать и это будет сделано в одной из следующих глав, что коэффициенты распределения и разделения можно рассматривать в качестве меры адсорбируемости компонентов, которая возрастает при их увеличении. Если в некоторой системе коэффициенты распределения различаются на порядок и более, то считают, что адсорбция всех компонентов многокомпонентной смеси, кроме адсорбции вещества с наибольшим значением коэффициента распределения (будем далее называть его целевым), пренебрежимо мала. В этом часто встречающемся случае вместо адсорбции многокомпонентной смеси можно рассматривать индивидуальную адсорбцию целевого компонента.
|
|
|
Зависимость равновесной величины индивидуальной адсорбции вещества (целевого компонента) при постоянной температуре от его содержания в объемной фазе называют изотермой адсорбции. Зависимость от температуры при постоянном содержании (парциальном давлении) – изопикной (изобарой) адсорбции. Зависимость равновесного давления от температуры при постоянной величине адсорбции носит название изостеры адсорбции.
Поддержание постоянной температуры обеспечивается легче, чем поддержание постоянного содержания в любой из фаз. Поэтому экспериментальный материал по адсорбции обычно получают в виде изотерм. Они же часто являются первичным объектом теоретического анализа. На рис. 1. 1 приведены типичные изотермы адсорбции. Из рисунка видно, что величина адсорбции (Х) возрастает по мере увеличения концентрации (С) (парциального давления, Р) адсорбата и убывает с ростом температуры (Т).

Рис. 1. 1. Изотермы адсорбции: T1< T2< T3.
Теоретическая интерпретация изотерм, приведенных на рис. 1, для адсорбции на плоской поверхности адсорбента впервые была выполнена американским физиком Ленгмюром и по его имени изотермы такого типа, которые показаны на рисунке, стали называть ленгмюровскими (синоним: выпуклыми). Они очень часто встречаются в адсорбционных системах даже в тех случаях, когда допущения теории Ленгмюра не выполняются или выполняются не полностью. Уравнение Ленгмюра записывается так:
X = XmbC/(1 + bC), (1. 1)
где Xm – предельная величина адсорбции, отвечающая плато на изотерме, b – коэффициент, имеющий смысл константы равновесия.
При наличии изотерм адсорбции изопикны - изобары адсорбции получают путем сечения семейства изотерм вертикальными линиями, отвечающими условию С = const. Изостеры адсорбции получают путем сечения изотерм горизонтальными линиями, отвечающими условию: Х = const. Координаты точек пересечения вертикальных прямых с изотермами дают изопикны адсорбции, а пересечения горизонтальных линий с теми же изотермами – изостеры.
|
|
|
На рис. 1. 2 а приведены изостеры адсорбции в координатах С ~ T. На рис. 1. 2 б эти же изостеры представлены в координатах линейной формы уравнения Клапейрона-Клаузиуса:
LnC ~ - Δ H/RT, (1. 2)
где Δ Н – теплота адсорбции, кДж/моль; R – газовая постоянная, кДж/моль. К. По тангенсу угла наклона линейных в указанных координатах изостер адсорбции вычисляют изостерическую теплоту адсорбци, т. е. теплоту адсорбции при постоянной величине адсорбции.
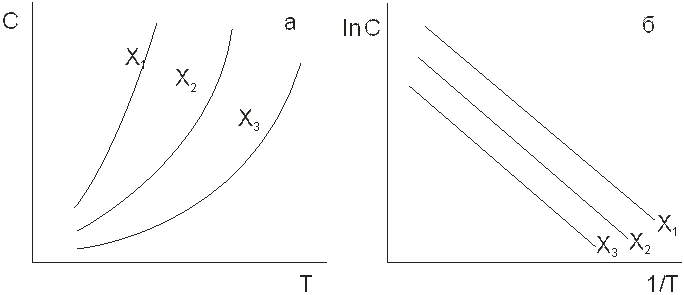
Рис. 1. 2. Изостеры адсорбции: а – в обычных координатах, б – в координатах уравнения Клапейрона - Клаузиуса, X. 1> X2> X3.
Одновременное использование изотерм и изостер адсорбции позволяет определить два важнейших свойства системы: величину и теплоту адсорбции. Отметим, что адсорбция – процесс экзотермичный и ее протекание всегда сопровождается выделением тепла.
|
|
|


