 |
Общие закономерности ионной полимеризации. Анионная полимеризация. Типичные мономеры и катализаторы.
|
|
|
|
Ионная полимеризация – реакция полимеризации, инициаторами которой являются ионы или поляризованные частицы. Ионную полимеризацию подразделяют на анионную и катионную, инициаторами которых являются, соответственно, анионы или катионы. Кроме того, существует координационно-ионная полимеризация.
Схематически ионную полимеризацию можно изобразить следующим образом:
 - катионная полимеризация
- катионная полимеризация
 - анионная полимеризация
- анионная полимеризация
Имеется стадия инициирования цепи
 ,
,
стадия роста цепи

…………………….
и стадия обрыва цепи

Во многих случаях реакции ионной полимеризации могут протекать и без стадии обрыва цепи.
Анионная полимеризация
Анионной полимеризацией называется процесс ионной полимеризации, в которой инициатором является анион.

Общую схему активации мономера анионом можно представить в виде:

или

А- - различные нуклеофилы (чаще всего - основания с различной силой).
Основные стадии:
Инициирование

Причем "Х" — не галоген. Галогензамещенные винилы не вступают в такую реакцию, они малоактивны (ПВХ получают по радикальному механизму).
Рост цепи

3. Реакция обрыва цепи (протекает с участием растворителя, например, аммиаком)
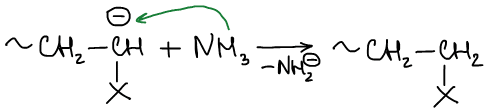

Мономеры, вступающие в процесс анионной полимеризации
Это соединения с кратной связью, имеющие при ней электроноакцепторные заместители:

заместителями могут быть различные группы:






Другие двойные связи также способны раскрываться под действием аниона:
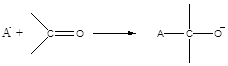

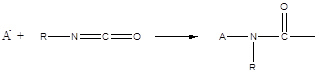
По анионному механизму полимеризуется также ряд циклических мономеров:
1. Циклические оксиды

2. Лактоны
|
|
|
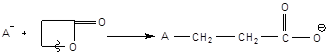
3. Лактамы



4. N-карбоксиангидриды α-аминокислот

место атаки мономера

|

Заметим, что в случае (3) и (4) отрицательный заряд локализован не на конце растущей цепи, а на депротонированных молекулах мономера (лактама, N-карбоксиангидрида), которые следует определять как «активированные мономеры». В случае (4) после присоединения мономера с раскрытием цикла происходит отщепление молекулы CO2, вследствие чего состав образующегося полимера (полипептида) не соответствует составу исходного мономера. Тем не менее, эту реакцию рассматривают как полимеризацию по цепному механизму.
5. Циклосилоксаны

Инициаторы анионной полимеризации
Слабые основания
H2O, NH3, NR2H
Эти инициаторы способны активизировать ограниченное количество мономеров, способных вступать в реакции анионной полимеризации (например, цианакрилаты).
Основания средней силы
К этой группе относятся соединения, имеющие карбоксильную группу, аминогруппу (-NH2), алкоголяты щелочных металлов, гидроксиды щелочных металлов.
Эти инициаторы способны вступать в реакции анионной полимеризации со стиролом, метакрилатами, акрилонитрилом.
Сильные основания
Алкилы щелочных или щелочноземельных металлов.
Эти инициаторы способны вступать в реакцию анионной полимеризации даже с изопреном.
Остановимся подробнее на сильных основаниях.
Противоионами могут выступать ионы Li, Na, K, Rb, Cs, Са, Mg, Zn или Al.
Металлорганические соединения этих элементов довольно устойчивы, способны диссоциировать, давая свободные ионы или образуя ионные пары К+Х-:

В отсутствие ингибиторов (см. ниже) реакции гибели нуклеофильных активных центров не происходит, поэтому подобные инициаторы приводят к образованию т. н. "живых цепей".
Часто в качестве инициатора анионной полимеризации используют бутиллитий - С4H9Li.
|
|
|
Возможно использовать в качестве возбудителей щелочные и щелочноземельные металлы. Такая возможность обусловлена тем, что атомы металлов легко отщепляют электроны, образуя стабильные частицы (ионы):

В качестве акцептора электрона могут выступать аммиак, ароматические соединения, а также непосредственно мономеры. Например, натрий в бескислородном растворителе с нафталином образует натрийнафталиновый комплекс с голубой окраской:
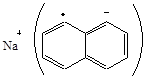
Этот комплекс легко отдает электрон мономеру, давая соответствующий анион-радикал M∙-, последние быстро рекомбинируют, образуя дианионы:
2М∙- → -ММ-
При участии дианионов цепь растет в оба конца.
В случае бутадиена реакцию можно записать следующим образом:

Видно, что при инициировании щелочными металлами образование металлорганических соединений происходит непосредственно в реакционной системе и при этом образуются дианионы, способные вести дальнейшее присоединение молекул мономера в обоих направлениях.
Можно использовать также для полимеризации трианионы, тетраанионы, полианионы, при этом образуются звездообразные макромолекулы с тремя, четырьмя и более лучами.
При замене ионы металла на ионы водорода, т. е. при реакции с соединениями, содержащими подвижный протон, образуется ковалентная связь С–Н и реакция прекращается.
Существуют основания, не имеющие заряда, но при их реакции с мономером заряд образуется. Примером может являться реакция образования бетаинов при инициировании триалкилфосфином:

Рассмотрим влияние инициаторов анионной полимеризации на различные циклические мономеры.

- этиленоксид легко полимеризуется с большинством инициаторов анионной полимеризации (RO-, HO-, R-, -COO-, и т. д.), по механизму «живых цепей» образуя полимер с достаточно узким ММР ( ), степень полимеризации определяется как отношение концентрации мономера в системе к концентрации инициатора:
), степень полимеризации определяется как отношение концентрации мономера в системе к концентрации инициатора:
 (10.2.1)
(10.2.1)
Также хорошо вступает в реакцию пропиленоксид. Можно получать этим методом двух и трехблочные сополимеры полиоксиэтилена и полиоксипропилена с различными значениями ГЛБ (ГЛБ определяет состав полученного сополимера).
Этим методом можно получать полиэтиленсульфид, полипропиленсульфид.
|
|
|
Легко идет реакция с лактоном пропионовой кислоты:

Хорошо также полимеризуются лактид молочной кислоты (лактон), гексаметилсилоксан.
При реакции с участием N-карбоксиангидридов α-аминокислот можно получать полипептиды:

Реакции роста цепи
Реакция роста цепи может протекать с участием всех форм существования активных центров (ассоциаты металлорганических соединений (МОС) ↔ мономерная форма МОС ↔ контактные ионные пары ↔ сольватно-разделенные ионные пары ↔ свободные ионы). Отсутствие гибели активных центров позволяет определить вклад каждой из форм активного центра в суммарную скорость роста цепи. Так при полимеризации стирола константа скорости роста с участием свободного иона составляет примерно 104-105 л•моль/с (для сравнения константа скорости на ионных парах и в радикальной полимеризации составляет примерно 102 л•моль/с, т.е. свободный ион значительно активнее, чем ионная пара или свободный радикал). Поэтому даже при низких концентрациях свободных ионов их вклад в реакцию роста может быть значительным.
|
|
|


