 |
Для чего используется исследование?
|
|
|
|
Для чего используется исследование?
Для диагностики и контроля лечения многих заболеваний.
Когда назначается исследование?
ü Во время профилактического осмотра;
ü при наличии у пациента жалоб или симптомов какого-либо заболевания.
Что означают результаты?
ЛЕЙКОЦИТЫ (WBC)

ЭРИТРОЦИТЫ (RBC)

ГЕМОГЛОБИН (HGB)

ГЕМАТОКРИТ (HCT)

СРЕДНИЙ ОБЪЕМ ЭРИТРОЦИТА (MCV)
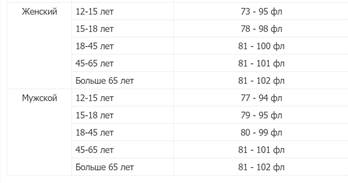
СРЕДНЕЕ СОДЕРЖАНИЕ ГЕМОГЛОБИНА В ЭРИТРОЦИТЕ (MCH)

СРЕДНЯЯ КОНЦЕНТРАЦИЯ ГЕМОГЛОБИНА В ЭРИТРОЦИТЕ (MCHC)

ТРОМБОЦИТЫ (PLT)

Распределение тромбоцитов по объему (PDW): 10 - 20 fL.
Средний объем тромбоцита (MPV): 9, 4 - 12, 4 fL.
Коэффициент больших тромбоцитов (P-LCR): 13 - 43 %.




Единицы измерения
ü *10^9/л – 10 в ст. 9/л;
ü *10^12/л – 10 в ст. 12/л;
ü г/л – грамм на литр;
ü fL – фемтолитр;
ü пг – пикограмм;
ü % – процент;
ü мм/ч. – миллиметр в час.
Интерпретация анализа:
1. Анемия
Снижение гемоглобина и/или эритроцитов свидетельствует о наличии анемии. С помощью показателя MCV можно провести первичную дифференциальную диагностику анемий:
ü MCV менее 80 fl (микроцитарная анемия). Причины:
ü железодефицитная анемия,
ü талассемия,
ü анемия хронического заболевания,
ü сидеробластическая анемия.
Учитывая, что самой частой причиной микроцитарной анемии является дефицит железа, при выявлении микроцитарной анемии рекомендуется определение концентрации ферритина, а также железа сыворотки и общей железосвязывающей способности сыворотки. Рекомендуется обратить внимание на показатель RDW (увеличен только при железодефицитной анемии) и количество тромбоцитов (часто увеличено при железодефицитной анемии).
|
|
|
MCV 80-100 fl (нормоцитарная анемия). Причины:
ü кровотечение,
ü анемия при ХПН,
ü гемолиз,
ü анемия при недостаточности железа или витамина B12.
MCV более 100 fl (макроцитарная анемия). Причины:
ü злоупотребление алкоголем,
ü лекарственные препараты (гидроксимочевина, зидовудин),
ü дефицит витамина B12 и фолиевой кислоты.
Выраженный макроцитоз (MCV более 110 fl), как правило, указывает на первичное заболевание костного мозга.
При анемии вне зависимости от ее вида СОЭ, как правило, повышена.
2. Тромбоцитопения
Причины:
ü тромбоцитопеническая пурпура / гемолитико-уремический синдром;
ü ДВС-синдром (диссеминированное внутрисосудистое свертывание);
ü лекарственная тромбоцитопения (ко-тримоксазол, прокаинамид, тиазидовые диуретики, гепарин);
ü гиперспленизм;
ü идиопатическая тромбоцитопеническая пурпура.
ü Следует помнить, что у беременных женщин в норме тромбоциты могут снижаться до 75-150× 109/л.
3. Лейкопения
Для дифференциальной диагностики лейкопений имеет значение как абсолютное количество каждого из 5 основных ростков лейкоцитов, так и их процентное соотношение (лейкоцитарная формула).
Нейтропения. Снижение нейтрофилов менее 0, 5× 109/л – тяжелая нейтропения.
Причины:
ü Врождённый агранулоцитоз (синдром Костманна);
ü Лекарственная нейтропения (карбамазепин, пенициллины, клозапин и другие);
ü Инфекции (сепсис, вирусная инфекция);
ü Аутоиммунная нейтропения (СКВ, синдром Фелти).
Лимфопения. Причины:
ü Врождённая лимфопения (агаммаглобулинемия Брутона, тяжелый комбинированный иммунодефицит, синдром ди Джорджи);
ü Приобретенный вариабельный иммунодефицит;
ü Лекарственная лимфопения (глюкокортикостероиды, моноклональные антитела);
ü Вирусная инфекция (ВИЧ);
ü Аутоиммунная лимфопения (СКВ, ревматоидный артрит, саркоидоз);
|
|
|
ü ХПН;
ü Туберкулез.
4. Полицитемия
Увеличение концентрации Hb и/или Ht и/или количества эритроцитов может наблюдаться при:
Истинная полицитемия – миелопролиферативное заболевание. В анализе крови кроме эритроцитоза наблюдается тромбоцитоз и лейкоцитоз.
Относительная полицитемия (компенсаторный ответ костного мозга на гипоксию при ХОБЛ или ИБС; избыток эритропоэтина при почечно-клеточной карциноме).
Для дифференциальной диагностики полицитемии рекомендуется исследование уровня эритропоэтина.
Тромбоцитоз
Причины:
ü Первичный тромбоцитоз (злокачественное заболевание миелоидного ростка костного мозга, в том числе эссенциальный тромбоцитоз и хронический миелолейкоз);
ü Вторичный тромбоцитоз после удаления селезенки, при инфекционном процессе, железодефицитной анемии, гемолизе, травме и злокачественных заболеваниях (реактивный тромбоцитоз).
ü Повышение Hb, MCV или общего количества лейкоцитов свидетельствует в пользу первичного тромбоцитоза.
Лейкоцитоз
Первым шагом при интерпретации лейкоцитоза является оценка лейкоцитарной формулы. Лейкоцитоз может быть обусловлен избытком незрелых лейкоцитов (бластов) при остром лейкозе или зрелых, дифференцированных лейкоцитов (гранулоцитоз, моноцитоз, лимфоцитоз).
Гранулоцитоз - нейтрофилия. Причины:
ü Лейкемоидная реакция (реактивная нейтрофилия при наличии инфекции, воспаления, применения некоторых лекарственных средств);
ü Миелопролиферативное заболевание (например, хронический миелолейкоз).
ü Повышение палочкоядерных нейтрофилов более 6 % свидетельствует о наличии инфекции, но также может наблюдаться при хроническом миелолейкозе и других миелопролиферативных заболеваниях.
ü Также косвенным признаком инфекционного процесса является увеличение СОЭ, которое, однако, может наблюдаться и при многих злокачественных заболеваниях.
Гранулоцитоз - эозинофилия. Причины:
ü Первичная эозинофилия (гиперэозинофильный миелопролиферативный синдром);
ü Вторичная эозинофилия (паразитозы, гельминтозы, аллергия, васкулиты, лимфома).
Гранулоцитоз - базофилия. Причины:
ü Хронический базофильный лейкоз.
|
|
|
ü Моноцитоз. Причины:
ü Миелопролиферативное заболевание, например, ХМЛ;
Реактивный моноцитоз (хронические инфекции, гранулематозное воспаление, лучевая терапия, лимфома).
Лимфоцитоз.
Причины:
ü Реактивный лимфоцитоз (вирусная инфекция). Рекомендуется проведение специфических для вирусов лабораторных тестов.
ü Лимфолейкоз (острый и хронический).
Клинический анализ крови: общий анализ, лейкоцитарная формула, СОЭ (с микроскопией мазка крови при выявлении патологических изменений) – это скрининговый метод, с помощью которого можно заподозрить или исключить многие заболевания. Этот анализ, однако, не всегда позволяет установить причину изменений, при выявлении которых, как правило, требуются дополнительные лабораторные, в том числе патоморфологические и гистохимические исследования. Наиболее точная информация может быть получена при динамическом наблюдении изменений показателей крови.
Что может влиять на результат?
ü Пол;
ü возраст;
ü раса;
ü беременность;
ü наличие сопутствующих заболеваний;
ü применение лекарственных средств.
ВОПРОС 3 ЗНАНИЯ. ТЕХНИКА ВЗЯТИЯ КРОВИ ИЗ ПАЛЬЦА
Клинический анализ капиллярной крови включает в себя определение концентрации гемоглобина, количества эритроцитов, лейкоцитов и тромбоцитов, величины гематокрита и эритроцитарных индексов (MCV, RDW, MCH, MCHC), формулу крови (процентное соотношение различных видов лейкоцитов (нейтрофилы, лимфоциты, эозинофилы, моноциты, базофилы)). Дополнительно, в случае необходимости, измеряется скорость оседания эритроцитов( СОЭ).
При проведении профосмотров и диспансеризаций по капиллярной крови измеряют содержание глюкозы и проводят экспресс-тесты уровня холестерина.
ПОДГОТОВКА К ИССЛЕДОВАНИЮ
Процедуру проводят в утренние часы, обычно с 8. 00 – до 10: 00, – натощак: предыдущий прием пищи накануне вечером должен быть минимум за 12 часов до взятия. С утра в день исследования можно только пить воду.
За несколько дней до анализа желательно исключить из рациона жирную пищу и алкоголь. Также рекомендуется временно ограничить физические нагрузки, по возможности высыпаться и избегать стрессов. Перед процедурой крайне не рекомендовано курить.
|
|
|
ПРАВИЛА ВЗЯТИЯ КАПИЛЛЯРНОЙ КРОВИ
Инструмент
Палец прокалывают одноразовым стерильным скарификатором – это исключает риск инфицирования. Размер иглы или лезвия подбирается индивидуально, в зависимости от возраста и физических (физиологических) особенностей пациента. Современные автоматические скарификаторы снижают и болевые ощущения, и волнение пациента.
При заборе крови следует помнить о возможной ее инфицированности вирусом СПИДа, гепатита В и связанным с этим повышенным риском заражения, которому подвергаются лаборанты, проводящие серологические и клинические исследования. Поэтому при проведении анализа крови нужно руководствоваться правилами о профилактике СПИДа у медицинского персонала, занятого забором крови и ее исследованием.
Х о д р а б о т ы
1. Пациент должен сидеть напротив проводящего забор крови, рука (лучше левая) находится на столе.
2. Забор крови осуществляют из 4-го пальца, т. к. синовиальное влагалище его изолировано, что предотвращает распространение воспалительного процесса в случае его возникновения на кисть.
3. Кожа пальца дезинфицируется и обезжиривается спирт-эфиром.
4. Скарификатор берут пинцетом из стерилизатора за середину, а затем рукой за конец, противоположный колющему, подняв скарификатор острием вверх, чтобы капля воды не стекала на режущий край. Лучше пользоваться одноразовыми скарификаторами.
5. Прокол кожи делают в подушечке пальца в центральной точке, скарификатор погружают на всю глубину режущей поверхности.
6. Первую каплю крови снимают сухой ватой, тщательно вытирают палец (кожа должна быть сухой).
7. Следующая капля крови должна иметь выпуклый мениск и не растекаться по пальцу, из этой и последующей капель кровь берется для анализа.
8. Полностью заполнить капилляр кровью. Для того, чтобы избежать появления воздуха в микропробирке, держите микропробирку во время взятия крови в горизонтальном положении (рисунок 4в).
9. Для получения достаточного количества крови следует держать капилляр и про- бирку в горизонтальном положении для лучшего стекания крови из капилляра в пробирку
10. Если все пробирки заполнены кровью, то на место прокола следует поместить салфетку, смоченную дезинфицирующим раствором и сдавить на 3-5 минут.
11. Удалить капилляр с микропробирки и закрыть пробирку пробкой.
12. При использовании микропробирки с добавлениями следует смешать кровь и содержащуюся в пробирке добавку. Для этого достаточно резкими движениями следует перевернуть пробирку дном вверх и обратно 5-10 раз.
|
|
|
13. Маркировать пробирки.
14. Все используемые во взятие крови необходимые средства собрать в специальный контейнер
15. После забора крови место укола обрабатывается спиртом или настойкой йода.
ГЕМОГРАММА
При анализе гемограммы рекомендуется:
1. Дать оценку состояния красного ростка кроветворения: сравнить с нормальными значениями количество гемоглобина, эритроцитов, ретикулоцитов, вычислить цветовой показатель. Оценить и проанализировать изменения морфологических свойств эритроцитов, способность костного мозга к регенерации.
2. Оценить изменения общего количества лейкоцитов (лейкоцитоз, лейкопения) и лейкоцитарной формулы (процентного содержания различных видов лейкоцитов).
3. Подсчитать абсолютное содержание каждого вида лейкоцитов в единице объема крови и выяснить, для каких видов лейкоцитов они являются абсолютными (увеличение или уменьшение содержания в единице объема крови) или относительными (изменение процентного содержания и нормальное количество в абсолютных цифрах).
4. Если есть изменения в соотношении зрелых и незрелых форм нейтрофилов, то определить характер ядерного сдвига.
5. Обратить внимание на изменения морфологических свойств лейкоцитов, появление низкодифференцированных форм лейкоцитов (бластов) в периферической крови.
6. Оценить показатели количества тромбоцитов, СОЭ.
7. Проанализировать показатели всех кроветворных ростков, оценить степень выраженности этих изменений. Дать обоснованное заключение о состоянии системы кроветворения и классифицировать нарушения. Указать их возможные причины, механизм развития, оценить компенсаторно-приспособительные возможности системы кроветворения и дать прогноз обнаруженным отклонениям.
Цветовой показатель - нормальное его значение у людей любого возраста составляет 0, 85-1, 15. Цветовой показатель крови является показателем степени насыщения эритроцитов гемоглобином и отражает соотношение между количеством эритроцитов и гемоглобина в крови. Когда его значения отличаются от нормы, то в основном это свидетельствует о наличии анемии. В данном случае анемии делятся на:
- гипохромные - цветной показатель меньше 0, 85;
- гиперхромные - цветной показатель больше 1, 15.
Однако анемии могут быть и нормохромные - когда цветовой показатель остается в пределах нормы.
Этот показатель можно вычислить, зная содержание гемоглобина в исследуемой крови и количество эритроцитов в 1 мкл этой же крови.
ЦП = Нв (г/л) * 3 / (три первых цифры от числа эритроцитов)

ВОПРОС 2 ЗНАНИЯ. ОПРЕДЕЛЕНИЕ ОСМОТИЧЕСКОЙ РЕЗИСТЕНТНОСТИ ЭРИТРОЦИТОВ
Тест на осмотическую резистентность эритроцитов заключается в измерении их устойчивости к гемолизу при воздействии солевых растворов разной концентрации. Когда эритроциты попадают в гипотоническую среду, вода по осмотическому градиенту устремляется в клетки, что может приводить к разрушению и лизису (гемолизу) эритроцитов. Осмотическая устойчивость характеризует способность эритроцитов принимать воду без лизиса клетки, она зависит, в частности, от соотношения площади поверхности к объему клетки.
С какой целью исследуют Осмотическую резистентность эритроцитов
Оценка осмотической резистентности эритроцитов – классический тест, используемый в диагностике наследственного сфероцитоза. Наследственный сфероцитоз – гетерогенная группа наследственных гемолитических анемий, развивающихся вследствие генетических дефектов, которые приводят к дефекту или дисфункции белков мембраны и цитоскелета эритроцитов, в результате чего эритроциты приобретают характерную сферическую форму. Это приводят к ускоренному разрушению эритроцитов в селезенке и укорочению их срока жизни.
Показания для проведения исследования:
подозрение на гемолитическую анемию

ВОПРОС 1 ЗНАНИЯ. СОВРЕМЕННЫЕ АВТОМАТИЗИРОВАННЫЕ МЕТОДИКИ ИССЛЕДОВАНИЯ СОСТАВА И СВОЙСТВА КРОВИ. ФОТОГЕМОМЕТРИЯ
ü Электронно-автоматический метод
Он основан на разных принципах, но наиболее часто применяется импульсный принцип - разница электропроводности частиц крови и разбавляющей их жидкости. Определённое количество разведённой 0, 85% раствором NaCl (или другим электролитом) крови пропускают через микроотверстие. Проходящая клетка увеличивает сопротивление между электродами, возникающий импульс передаётся на счётное устройство с цифровой индикацией. Производительность аппаратов этого типа велика: процесс подсчёта длится не более 20 с, ошибка 1-2%.
Анализа́ тор гематологи́ ческий — прибор (комплекс оборудования), предназначенный для проведения количественных исследований клеток крови в клинико-диагностических лабораториях. Может быть автоматическим или полуавтоматическим.
Полуавтоматический гематологический анализатор от автоматического отличается тем, что процесс разведения пробы крови осуществляется отдельным прибором — дилютером. После приготовления разведения цельной крови оператор должен перенести разведенную пробу в модуль измерения.
В настоящее время полуавтоматические анализаторы практически не выпускаются.
Автоматический гематологический анализатор представляет собой полностью автоматизированный прибор, в котором весь аналитический процесс выполняется автоматически.
Современные автоматические анализаторы способны обрабатывать десятки образцов (от 60 до 120) в час, с соответствующей спецификации точностью и воспроизводимостью, а также хранить результаты тестов во встроенной памяти и, при необходимости, распечатывать их на встроенном термопринтере или внешнем принтере.
Современные гематологические анализаторы классифицируются по номенклатуре определяемых показателей клеток крови.
Восьми-параметровые гематологические анализаторы определяют следующие параметры: концентрации эритроцитов (RBC), лейкоцитов (WBC), тромбоцитов (Plt), гемоглобина (Hb), а также следующие параметры эритроцитов: средний объем эритроцитов (MCV), среднее содержание гемоглобина в эритроцитах (MCH), среднюю концентрацию гемоглобина в эритроцитах (MCHC), гематокрит (Hct).
Восьми параметровые гематологические анализаторы в настоящее время практически не производятся.
Гематологические анализаторы класса 3-диф. Гематологические анализаторы класса 3-диф, в зависимости от выпускаемой модели, позволяют определять от 16 до 22 показателей клеток крови.
Анализаторы этого класса, помимо тех параметров, которые определяют восьми-параметровые анализаторы определяют три субпопуляции лейкоцитов: концентрации лимфоцитов (Lm), гранулоцитов (Gr) и, так называемых средних лейкоцитов (Mid), а также их процентное содержание Lm%, Gr% и Mid%. Отсюда и название класса 3-диф. Кроме этого гематологические анализаторы этого класса определяют коэффициент вариации объема эритроцитов (RDW) и ряд показателей, характеризующих тромбоциты: средний объем тромбоцитов (MPV), долю объема тромбоцитов(Tct) (аналог гематокрита), коэффициент вариации объема тромбоцитов (PDW).
Важной диагностической информацией, которую позволяет получить гематологические анализаторы этого класса, являются функции распределения по объему эритроцитов, лейкоцитов и тромбоцитов — гистограммы.
Гематологические анализаторы класса 5-диф. Основным отличием гематологических анализаторов 5-диф от анализаторов 3-диф является их способность определять все 5 субпопуляций лейкоцитов: лимфоциты (Lym), моноциты (Mon), нейтрофилы (Neu), базофилы (Bas) и эозинофилы (Eos), а также их процентное содержание Lym%, Mon%, Neu%, Bas% и Eos%. Импедансный метод подсчета, известный также как счетчик Коултера, применяемый в анализаторах 3-диф, не в состоянии различить нейтрофилы, базофилы и эозинофилы, по этому в анализаторах 5-диф применяется иной метод дифференцировки клеток. Он основан на принципе дифракции лазерного излучения на клетках лейкоцитов и дальнейшем анализе рассеянного излучения. «Средние» лейкоциты не отличаются по размеру настолько что бы различать их импедансным методом, но имеют различную внутреннюю структуру и по-разному взаимодействуют с красителями. А метод детектирования дифракционной картины оказывается чувствительным ко внутренней структуре клеток. Таким образом эритроциты и тромбоциты подсчитываются счетчиком Коултера, а лейкоциты отдельным лазерным блоком.
ü Фотогемометрия
Это более точный метод определения содержания гемоглобина. Так цианметгемоглобиновый фотометрический метод основан на превращении гемоглобина в цианметгемоглобин (окрашенное стойкое соединение) под влиянием сложного раствора, содержащего NaHCO3 - 1г, K3[Fe(CN)6] - 0, 2 г и дистиллированную воду - до объёма 1л (или применяется другой реактив с подобным действием).
Под влиянием железосинеродистого калия гемоглобин окисляется до метгемоглобина, который при действии цианида калия превращается в цианметгемоглобин. Соотношение крови и реактива - 1: 250 (0, 02 мл крови и 5 мл реактива). Через 20 мин, необходимых для взаимодействия, определяют концентрацию цианметгемоглобина с помощью спектрометра либо фотоэлектроколориметра (ФЭК).
ü Цитофотометрия
Этот метод основан на фотометрическом измерении степени поглощения света определённых длин волн, например, взвесью эритроцитов. Процент задержанного света прямо пропорционален числу эритроцитов.
В качестве разводящей жидкости используют 3, 5% раствор NaCl. Готовят разведение крови 1: 500 и 1: 700 и определяют на фотоэлектрокалориметре с учётом построенной калибровочной кривой число эритроцитов. Этот метод удобен для серийной работы, однако недостатком его является зависимость результата не только от количества эритроцитов, но и от их размера и концентрации гемоглобина. Ошибка при этом методе может достигать 30-40%.
ü Тромбоэластография
Это метод записи процесса свёртывания крови и образования сгустка на тромбоэластографе.
|
|
|


