 |
Задача №1. ТЕМА 2. СТРОЕНИЕ АТОМА
|
|
|
|
Задача №1
а) напишите молекулярные и ионные уравнения, протекающие между H2SO4 и веществами: 1) NaOH, 2) Fe, 3) CuO, 4) SO2, 5) NaCl;
б) составьте уравнения реакций, протекающих в цепи превращений:
Fe → FeO → FeSO4 → Fe(OH)2 → FeO → Fe;
в) составьте уравнения всех реакций, протекающих между веществами H3PO4 и NaOH;
г) назовите перечисленные ниже соединения и определите класс – Ca(HCO3)2, FeСl3, CuOHCl, H3BO3, Cu2O, K2CrO4, H2F2, P2O5.
Решение:
а) Выберем вещества, с которыми взаимодействуют кислоты, помня:


 Ме до Н
Ме до Н
( НСl, разб. H2SO4)
3.
 |
Осн. 2. 4. Солями
оксидами слабых и
летучих
! 1. кислот
Осн-ми
 |
Отсюда следует, что H2SO4 взаимодействует: с NaOH, Fe, CuO.
· Составляем молекулярное уравнение реакции:
H2SO4 + 2 NaOH → Na2SO4 + 2 H2O.
· Составляем ионное уравнение реакции, зная п. 5 данной темы:
а) полное ионное уравнение
2 H+ + SO42- + 2 Na+ + 2 OH‾ → 2 Na+ + SO42- + 2 H2O;
сокращаем в полном ионном уравнении частицы
2 H+ + SO42- + 2 Na+ + 2 OH‾ → 2 Na+ + SO42- + 2 H2O;
б) и получаем краткое ионное уравнение
2 H+ + 2 OH‾ → 2 H2O.
· H2SO4 + Fe → FeSO4 + H2
а) 2H++SO42-+Fe→ Fe2++SO42-+H2
б) 2H++Fe→ Fe2++H2
· H2SO4 + CuO → CuSO4 + H2O
а) 2H++SO42-+СuO→ Cu2++SO42-+H2O
б) 2H++CuO→ Cu2++H2O
 б) ● Fe + O2 t˚ 2 FeO;
б) ● Fe + O2 t˚ 2 FeO;
· FeO +H2SO4 → FeSO4 + H2O;
· FeSO4 + 2 NaOH → Fe(OH)2 + Na2SO4;
·  Fe(OH)2 t˚ FeO + H2O;
Fe(OH)2 t˚ FeO + H2O;
· 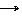 FeO + C t˚ Fe + CO.
FeO + C t˚ Fe + CO.
в) Реакция взаимодействия кислоты (H3PO4) с основанием (NaOH) может протекать в разных количественных соотношениях:
|
|
|
· 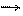 H3PO4 + 3NaOH Na3PO4 + 3 H2O; полная нейтрализация
H3PO4 + 3NaOH Na3PO4 + 3 H2O; полная нейтрализация
ортофосфат натрия
· 
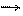 H3PO4 + 2NaOH Na2HPO4 + 2 H2O;
H3PO4 + 2NaOH Na2HPO4 + 2 H2O;
гидроортофосфат натрия неполная нейтрализация
·  H3PO4 + NaOH NaH2PO4 + H2O.
H3PO4 + NaOH NaH2PO4 + H2O.
дигидроортофосфат натрия
Это реакции нейтрализации, т. к. в результате образуются соли и вода (H/OH). При полной нейтрализации (1: 3) образуется нормальная соль.
При неполной нейтрализации (1: 2) и (1: 1) образуются кислые соли.
г) Сa(HCO3)2 – гидрокарбонат кальция (кислая соль).
FeCl3 – хлорид железа (III) нормальная соль
CuOHCl – гидроксохлорид меди (II) (основная соль)
H3BO3 – борная кислота (кислота)
Cu2O – оксид меди (I) (основной оксид)
K2CrO4 – хромат калия (соль нормальная)
H2F2 – димер плавиковой кислоты (кислота)
P2O5 –оксид фосфора (V)(кислотный оксид)
ТЕМА 2. СТРОЕНИЕ АТОМА
Современное состояние:
 1924 г. Луи де Броиль – двойственная природа электрона (корпускулярно-волновой дуализм).
1924 г. Луи де Броиль – двойственная природа электрона (корпускулярно-волновой дуализм).
электрон – частица (m, υ, q)
электрон – волна (дифракция)


 1927 г. В. Гейзенберг – принцип неопределенности (положение (е) вокруг ядра определить невозможно) при вращении (е) образуется атомная орбиталь (А: О) (электронное облако) – область пространства вокруг ядра, в котором вероятность нахождения электрона более 95 %.
1927 г. В. Гейзенберг – принцип неопределенности (положение (е) вокруг ядра определить невозможно) при вращении (е) образуется атомная орбиталь (А: О) (электронное облако) – область пространства вокруг ядра, в котором вероятность нахождения электрона более 95 %.
А. О. в виде шара называется s -орбиталь
А. О. в виде гантели называется p -орбиталь
А. О. в виде четырехлистника называется d -орбиталь
А. О. более сложной формы называется f -орбиталь
Таблица 3 – Квантовые числа, характеризующие состояние электрона в атоме
 Max (е) на Э. У. Max (е) на Э. У.
| Главное кв. Число n =1, 2, 3, 4, 5, 6, 7,... ∞ (Э. У. ) – запас энергии | Орбитальное кв. Число l = 0 до (n-1); форма орбитали, подуровень | Магнитное кв. Число m = - l, 0 + l положение орбитали в магнитных осях атома, число А. О. | Спиновое кв. ч. s = + ½ вращение А. О. вокруг своей оси | ||||||||||||||||||||||||||||||||||||||||||||||

2n2
|  n =1 (2e)
1s2 n =1 (2e)
1s2
 n = 2 (8 e )
2s22p6 n = 2 (8 e )
2s22p6
 n = 3 (18 e )
3s23p63d10 n = 3 (18 e )
3s23p63d10
 n = 4 (32 e )
4s24p64d104f14 n = 4 (32 e )
4s24p64d104f14
|  l = O (S) ∙
l = O (S)
l = 1 (P)
l = O (S)
l = 1 (P)
l = 2 (d)
l = O (S)
l = 1 (P)
l = 2 (d)
l = 3 (f) более сл. форма l = O (S) ∙
l = O (S)
l = 1 (P)
l = O (S)
l = 1 (P)
l = 2 (d)
l = O (S)
l = 1 (P)
l = 2 (d)
l = 3 (f) более сл. форма
| m = 0 (1 А. О. ) S ٱ m = -1, 0, +1 (3 А. О. ) p m = -2, -1, 0, +1, +2 d m = -3, -2, -1, 0, +1, +2, +3 f | ↑ (+1/2) ↓ (-1/2) | ||||||||||||||||||||||||||||||||||||||||||||||
| Выводы: Электроны в атоме закреплены за Э. У., которые в зависимости от формы А. О. расщепляются на подуровни, состоящие из А. О. | ||||||||||||||||||||||||||||||||||||||||||||||||||
Электронная структура многоэлектронных атомов:
| 1. Принцип минимальной энергии: Электроны в атоме заполняют тот подуровень, где меньше запас энергии. |
| 2. Правило Клечковского: Увеличение энергии и заполнение орбиталей происходит в порядке возрастания суммы квантовых чисел (n+l), а при равной сумме в порядке уменьшения числа nи увеличения числа l. Реальная электронная схема: 1s2< 2s2< 2p6< 3s2< 3p6< 4s2< 3d10< 4p6< 5s2< 4d10< 5p6< 4s2< 5d1< 4f14< 5d9< 6p6< 7s2< 6d1< 5f14< 6d9< 7p6 Исключение составляют элементы, у которых наблюдается провал электронов (медь, серебро, золото, хром, молибден, ниобий, рутений, родий, палладий, платина) |
3. Принцип Паули: В атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
 Следствие: В любой атомной орбитали может быть только два электрона с противоположными спинами ↑ ↓ Следствие: В любой атомной орбитали может быть только два электрона с противоположными спинами ↑ ↓
|
| 4. Правило Гунда: Электроны в пределах подуровня занимают максимальное число атомных орбиталей, но так чтобы их суммарный спин был максимальный. P3 ↑ ↑ ↑ 1/2 1/2 1/2 Σ =1, 5 |
| 5. Все химические элементы делят на семейства: s, p, d, f, в зависимости, какой подуровень заполняется в атоме последним. |
| 6. Валентные электроны – это электроны, участвующие в образовании химических связей. Валентные электроны расположены: у s – элементов в s орбиталях последнего Э. У. – ns у p – элементов в s и p орбиталях последнего Э. У. np ns у d – элементов в d орбиталях предпоследнего и s последнего Э. У. ns (n-1)d |
| 7. Возбуждение атома возможно при условиях: а) наличие в атоме спаренных электронов, б) наличие свободных А. О., в) при возбуждении электроны распариваются – переходят с одного подуровня на другой только в пределах последнего Э. У. |
          8. Химические элементы
Металлы Неметаллы
80 % 20 %
s, p, d, f s, p
1. R ат. > 1. R ат. 1. R ат. < 8. Химические элементы
Металлы Неметаллы
80 % 20 %
s, p, d, f s, p
1. R ат. > 1. R ат. 1. R ат. <
   2. Мало (е)-1, 2, 3 2. Число (е) на 2. Много (е)-4, 5, 6, 7
посл. Э. У. 2. Мало (е)-1, 2, 3 2. Число (е) на 2. Много (е)-4, 5, 6, 7
посл. Э. У.
 3. К отдаче (е) 3. Выражена 3. К принятию (е)
тенденция 3. К отдаче (е) 3. Выражена 3. К принятию (е)
тенденция
  Ме0-n(e)→ Ме+n неМе0+n(e)→ неМе-n
вос-ль окисление ок-ль восстановление Ме0-n(e)→ Ме+n неМе0+n(e)→ неМе-n
вос-ль окисление ок-ль восстановление
|
|
|
|
| 9. Степень окисления – условный заряд атома, вычисленный из предположения, что атом отдает либо принимает электроны. Ме проявляют только положительные степени окисления (С. О. ). Высшая (С. О. ) равна № группы. Исключения: IВ-(Cu, Ag, Au), VIIIB-(Fe, Co, Ni). |
| 10. НеМе проявляют, как отрицательные (низшие (С. О. ))=№ группы – 8, так и положительные (С. О. )=№ группы. Исключения: VIA(O), VIIA(F). |
| 11. Генетическая связь между классами неорганических веществ I. Ме→ Ме(+1, +2)+nО-2→ Ме+n(ОН)-1n Металл→ основной оксид→ основание II. неМе→ неМеО-2(Ме+5, +6, +7О-2)→ HR Неметалл→ кислотный оксид → кислота |
|
|
|
РЕШЕНИЕ ТИПОВОЙ ЗАДАЧИ ПО ТЕМЕ: «СТРОЕНИЕ АТОМА»
Проанализируйте с точки зрения строения атома элемент с порядковым № 12.
|
|
|







