 |
при произвольных условиях при стандартных условиях
|
|
|
|
при произвольных условиях при стандартных условиях
|
|
Пользуясь первым следствием из закона Гесса рассчитывают:
DНх. р., DSх. р., DGх. р.
|
|
В справочнике: DН°обр. , DS°обр. , DG°обр.
РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ ПО ТЕМЕ:
«ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ»
Задача №1
Определите теплоту образования хлорида аммония, если для реакции: NH3(Г) + HCl (Г) = NH4Cl, DНх. р. = - 176 кДж
и известны теплоты образования: DН°обр. (NH3) = - 46, 19 кДж/моль
DН°обр. (HCl) = -92, 30 кДж/моль
Решение
Запишем термохимическое уравнение реакции:
DН°обр. кДж/моль NH3(Г) + HCl (Г) = NH4Cl, DНх. р. = - 176 кДж
- 46, 19 - 92, 30 ?
Согласно следствию из закона Гесса:
DНх. р. = DН°обр. (NH4Cl) – [DН°обр. (NH3) + DН°обр. (HCl)]
Подставляем данные в следствие из закона Гесса.
-176, 9 = DН°обр. (NH4Cl) – [(- 46, 19) + (-92, 30)];
-176, 9 = DН°обр. (NH4Cl) + 138, 49;
Отсюда DН°обр. (NH4Cl) = -176, 9 - 138, 49 = - 315, 36 кДж/моль
Ответ: DН°обр. (NH4Cl) = - 315, 36 кДж/моль.
Задача №2
Определите тепловой эффект реакции, используя стандартные значения теплот образования веществ: SO3 + 2 KOH = K2SO4 + H2O(ж)
DHобр. SO3 = - 395, 2 кДж/моль;
KOH = -425, 93 кДж/моль;
H2SO4 = - 1433, 44 кДж/моль;
Н2О = -285, 84 кДж/моль.
Решение
Запишем термохимическое уравнение реакции:
DН°обр. кДж/моль SO3 + 2 KOH = K2SO4 + H2O(ж)
- 395, 2 - 425, 93 -1433, 44 -285, 84
Согласно следствию из закона Гесса:
|
|
|
DНх. р. = [(DН°обр. K2SO4 + DН°обр. H2O)] – [DН°обр. SO3 + 2 *DН°обр. KOH]
Подставляем данные в следствие из закона Гесса:
DНх. р. = [(-1433, 44) + (-285, 84)] – [(-395, 2) + 2 *(-425, 93)] = -472, 22 кДж.
/р. экзотермическая/
Ответ: DН°х. р. = -472, 22 кДж. => р. экзотермическая.
ТЕМА 5. ХИМИЧЕСКАЯ КИНЕТИКА
(СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ)
| Под скоростью химической реакции (Jх. р. ) понимают изменение концентрации реагирующих веществ в единицу времени. |
|
|
химические реакции
 |  | ||||
 | |||||

 Гомогенные Гетерогенные
Гомогенные Гетерогенные
в одной фазе, во всем объеме в разных фазах, на поверхности раздела фаз
ФАКТОРЫ, ВЛИЯЮЩИЕ НА Jх. р.:
1. Концентрация (давление), С (р) – ЗАКОН ДЕЙСТВУЮЩИХ МАСС (ЗДМ)
Скорость элементарной химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов.
nA + mB ®qC
 |
J = [A]n * [B]m *k
 |
[A] и [B] – концентрации веществ;
n и m – стехиометрические коэффициенты;
k – константа скорости химической реакции.
k = J, если [A] = [B] = 1моль/л
ЗДМ справедлив для газообразных веществ и жидких растворов.
2. Температура. ПРАВИЛО ВАНТ-ГОФФА.
При повышении температуры на каждые 10°С скорость реакции возрастает от 2 до 4 раз
|
Jt2 = Jt 1* g
g - температурный коэффициент Вант-Гоффа
g= (2 – 4) раза на каждые 10 °С
химические реакции
 Необратимые Обратимые
Необратимые Обратимые
|
|
|
до конца (до завершения) ®в двух взаимнопро-
(®), если образуется: тивоположных нап-


 а) осадок; равлениях ( )
а) осадок; равлениях ( )
б) газ;
в) слабый электролит.
Химическое равновесие – такое состояние системы, когда скорость прямой реакции равна скорости обратной реакции (J1 = J2), а концентрации всех веществ в системе становятся постоянными.
|
График зависимости скорости прямой и обратной реакции от времени

 J J1 пр.
J J1 пр.
J1 = J2 динамическое химическое равновесие
 |
J2 обр
 . t
. t
Вывод константы равновесия (К. р. )
Гомогенная реакция Гетерогенная реакция





 2 NO(Г) +O2(Г) « 2NO2(Г) Ca CO3(ТВ) « CaO(ТВ) + CO2(Г)
2 NO(Г) +O2(Г) « 2NO2(Г) Ca CO3(ТВ) « CaO(ТВ) + CO2(Г)
1. J1 = J2 (ЗДМ) 1. J1 = J2 (ЗДМ)
2. J1 = [NO]2 *[O2]*k1 2. J1 = k1
3. J2 = [NO2]2 *k2 3. J2 = [СO2] *k2
4. [NO]2 *[O2] *k1 = [NO2]2 *k2 4. k1 = [СO2] *k2
5. т. к. k1 и k2 – const, то 5. т. к. k1 и k2 – const, то
 6. k1 [NO2]2 6. k1 [СO2]
6. k1 [NO2]2 6. k1 [СO2]


 k2 [NO]2 *[O2] k2 1
k2 [NO]2 *[O2] k2 1





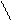

 k1 k1
k1 k1

 k2 Р
k2 Р  k2 р
k2 р



 7. [NO2]2 7. КР = [CO2]
7. [NO2]2 7. КР = [CO2]
 Р [NO]2 *[O2]
Р [NO]2 *[O2]
 | |||||
 | |||||
| |||||
 | |||
 | |||


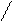 [C]q *[D]p для химической реакции (1)
[C]q *[D]p для химической реакции (1)

 Р [A]n *[B]
Р [A]n *[B]
 |
Смещение химического равновесия
Принцип Ле Шателье: если изменить одно из условий (С, р, Т), при которых система находилась в состоянии равновесия, то, равновесие смещается в сторону той реакции, которая противодействует произведённому изменению.
1. Влияние концентрации:
3 H2 + N2 « 2 NH3 3 H2 + N2 « 2 NH3
|
|
|
[H2] [H2]¯
 |  |
[N2] [N2] ¯
 | |||
 | |||
[NH3] [NH3] ¯
 | |||
 | |||
2. Влияние давления:

 3 H2 + N2 « 2 NH3
3 H2 + N2 « 2 NH3
3 +1 = 4 моль 2 моль
р р¯
р

р¯

3. Влияние температуры:
3 H2 + N2 « 2 NH3 (- D Н х. р. ) Þ экзотермическая реакция
t°¯ t°
 t°
t°
t°¯
C исходная = С равновесная + С израсходованная к моменту равновесия
С равновесная = С исходная – С израсходованная к моменту равновесия
РЕШЕНИЕ ТИПОВОЙ ЗАДАЧИ ПО ТЕМЕ:
«ХИМИЧЕСКАЯ КИНЕТИКА»
|
|
|


