 |
Микрокристаллоскопическая реакция
|
|
|
|
Уранилацетат  с ионами натрия в нейтральной среде образует характерные бесцветные или желтоватые кристаллы натрий-уранилацетата
с ионами натрия в нейтральной среде образует характерные бесцветные или желтоватые кристаллы натрий-уранилацетата  . Они представляют собой правильные тетраэдры или октаэдры.
. Они представляют собой правильные тетраэдры или октаэдры.
Для проведения реакции каплю раствора соли натрия осторожно выпаривают досуха на предметном стекле. Рядом помещают каплю раствора уранилацетата  и стеклянной палочкой соединяют с анализируемым сухим остатком. В присутствии ионов натрия через некоторое время появляются характерные октаэдрические и тетраэдрические кристаллы. Реакция специфична для ионов натрия. При совместном присутствии солей аммония и больших количеств ионов калия форма кристаллов меняется (игольчатые кристаллы
и стеклянной палочкой соединяют с анализируемым сухим остатком. В присутствии ионов натрия через некоторое время появляются характерные октаэдрические и тетраэдрические кристаллы. Реакция специфична для ионов натрия. При совместном присутствии солей аммония и больших количеств ионов калия форма кристаллов меняется (игольчатые кристаллы  ). Открытию ионов натрия мешают ионы серебра, сурьмы.
). Открытию ионов натрия мешают ионы серебра, сурьмы.
Чувствительность реакции повышается в присутствии солей магния и цинка. При этом образуются кристаллы более сложного состава, например, NaZn(UO2)3(CH3COO)9.9H2O.
Окрашивание пламени
Платиновую или нихромовую проволоку тщательно очищают от следов солей прокаливанием. Для этого ее смачивают в соляной кислоте и прокаливают в пламени горелки до полного исчезновения окраски пламени.
Смочите проволоку исследуемым раствором и внесите ее в бесцветное пламя горелки. Даже незначительное количество солей натрия окрашивает пламя в ярко-желтый цвет. Наиболее интенсивное окрашивание дают летучие соли, в частности хлориды. Если испытаниям подвергается неизвестная твердая соль, для образования хлорида её необходимо смочить на платиновой проволочке соляной кислотой.
Реакция очень чувствительна, поэтому о присутствии натрия можно судить в том случае, если интенсивно-желтая окраска не исчезнет через 10-15 секунд.
|
|
|
1.2 Частные реакции на катион K 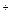
Винная кислота  или гидротартрат натрия
или гидротартрат натрия 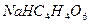 выделяют из нейтральных или слабокислых растворов солей калия белый кристаллический осадок гидротартрата калия:
выделяют из нейтральных или слабокислых растворов солей калия белый кристаллический осадок гидротартрата калия:



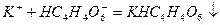
В пробирку налейте 4-5 капель раствора соли калия и прибавьте такой же объем раствора гидротартрата натрия 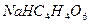 . Перемешайте содержимое пробирки стеклянной палочкой – выпадет белый кристаллический осадок
. Перемешайте содержимое пробирки стеклянной палочкой – выпадет белый кристаллический осадок  .
.
Для исследования свойств осадок взбалтывают и разливают в четыре пробирки. Одну порцию нагревают, причем осадок растворяется. Затем пробирку охлаждают под краном, осадок образуется снова. К нему добавляют 3-5 мл воды, и осадок растворяется.
Во вторую пробирку с осадком добавляют уксусную кислоту 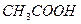 . В ней осадок не растворяется, так как уксусная кислота слабее, чем винная. В третью пробирку прибавляют сильную кислоту (серную или соляную), осадок растворяется, образуется слабая кислота.
. В ней осадок не растворяется, так как уксусная кислота слабее, чем винная. В третью пробирку прибавляют сильную кислоту (серную или соляную), осадок растворяется, образуется слабая кислота.

В четвёртую пробирку добавляют сильную щелочь (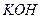 или
или 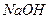 ). Осадок растворяется, так как образуется средняя соль
). Осадок растворяется, так как образуется средняя соль  , растворимая в воде:
, растворимая в воде:

Условия проведения реакции:
1. Испытуемый раствор должен быть достаточно концентрированным.
2. Реакцию следует проводить “на холоду” (без нагревания).
3. Среда раствора должна быть нейтральной.
4. Для ускорения осаждения необходимо применить внешнее воздействие (трение стеклянной палочкой о стенку пробирки).
Для создания необходимых условий открытия катиона катиона 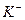 раствор концентрируют упариванием, затем охлаждают и нейтрализуют (если он кислый или щелочной). Для нейтрализации кислого раствора нельзя применять щелочь
раствор концентрируют упариванием, затем охлаждают и нейтрализуют (если он кислый или щелочной). Для нейтрализации кислого раствора нельзя применять щелочь 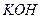 , содержащую катион
, содержащую катион 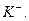 Если для открытия катиона применяют не соль
Если для открытия катиона применяют не соль 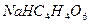 ,а кислоту
,а кислоту  , реакцию проводят в присутствии ацетата натрия, прибавляемого для нейтрализации выделяющейся сильной кислоты, в которой растворим осадок:
, реакцию проводят в присутствии ацетата натрия, прибавляемого для нейтрализации выделяющейся сильной кислоты, в которой растворим осадок:


Эта реакция является сравнительно малочувствительной (предельное разбавление 1:1000).
|
|
|
Кобальтинитрит натрия (гексанитритокобальтат натрия) Na3[Co(NO2)6] с катионами калия образует желтый кристаллический осадок двойной комплексной соли кобальтинитрита калия-натрия:
 .
.
Реакцию следует проводить в отсутствии щелочей и минеральных кислот, так как щелочи разлагают реактив  с выделением бурого осадка
с выделением бурого осадка  :
:

Соли аммония с кобальтинитритом натрия образуют аналогичный осадок и поэтому мешают открытию калия.
Условия проведения реакции:
1. Среда должна быть нейтральной или слабокислой (уксуснокислой), но не щелочной.
2. Соли аммония должны отсутствовать.
3. Иодиды и другие восстановители, окисляющие нитрит-ионы реактива, также должны отсутствовать.
4. Выпадение осадка может быть ускорено трением стеклянной палочкой.
Данная реакция является лучшей из всех реакций на ион калия, как по чувствительности, так и по селективности.
|
|
|


