 |
Вторая аналитическая группа катионов
|
|
|
|
Групповой реактив – соляная кислота 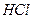 . Катионы
. Катионы  находятся в разных группах периодической системы, но все они при взаимодействии с
находятся в разных группах периодической системы, но все они при взаимодействии с 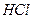 образуют труднорастворимые в воде и в разбавленных кислотах осадки:
образуют труднорастворимые в воде и в разбавленных кислотах осадки:






Следует избегать избытка соляной кислоты, так как могут образоваться комплексные соединения:


Растворимость хлоридов катионов второй группы различна. Осадок 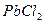 белого цвета, отличается хорошей растворимостью в горячей воде. Этим пользуются для отделения его от осадка
белого цвета, отличается хорошей растворимостью в горячей воде. Этим пользуются для отделения его от осадка  и
и  . Следует помнить, что хлорид свинца имеет значительную растворимость и в холодной воде (2 г/л при
. Следует помнить, что хлорид свинца имеет значительную растворимость и в холодной воде (2 г/л при  С). Поэтому ионы свинца
С). Поэтому ионы свинца  действием соляной кислоты осаждаются неполностью.
действием соляной кислоты осаждаются неполностью.
Белый творожистый осадок  на свету становится фиолетовым или даже черным (разложение
на свету становится фиолетовым или даже черным (разложение  до свободного серебра). В разбавленных кислотах
до свободного серебра). В разбавленных кислотах 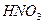 ,
,  хлорид серебра, как соль, образованная сильной кислотой, не растворяется. При действии аммиака или карбоната аммония
хлорид серебра, как соль, образованная сильной кислотой, не растворяется. При действии аммиака или карбоната аммония  хлорид серебра переходит в растворимый бесцветный комплекс:
хлорид серебра переходит в растворимый бесцветный комплекс:
 +
+  =
=  .
.
Этой реакцией пользуются для отделения  от
от  . Если аммиак, входящий в состав комплексной соли, связать действием кислоты в ион аммония
. Если аммиак, входящий в состав комплексной соли, связать действием кислоты в ион аммония 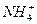 , то хлорид серебра снова выпадет в осадок:
, то хлорид серебра снова выпадет в осадок:
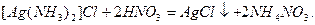
Этой реакцией пользуются для обнаружения ионов серебра. В отличие от  , белый осадок хлорида закисной ртути
, белый осадок хлорида закисной ртути  (каломель) при действии
(каломель) при действии 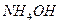 не растворяется, а темнеет, при этом сначала образуется амидохлорид ртути (I):
не растворяется, а темнеет, при этом сначала образуется амидохлорид ртути (I):
 +
+ 
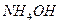 =
= 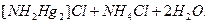
 - неустойчивое соединение, разлагается с выделением свободной ртути (почернение осадка) и образованием амидохлорида ртути (II):
- неустойчивое соединение, разлагается с выделением свободной ртути (почернение осадка) и образованием амидохлорида ртути (II):
 =
= 
Эта реакция характерна для открытия иона 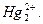 Проделайте описываемые ниже реакции, отметьте окраску и изучите свойства полученных осадков.
Проделайте описываемые ниже реакции, отметьте окраску и изучите свойства полученных осадков.
|
|
|
2.1 Частные реакции на катион серебра 
Соляная кислота HCl и растворимые хлориды NaCl образуют с ионом серебра белый творожистый осадок хлорида серебра AgCl:
AgNO3 + НСl = AgCl↓ + HNO3
Ag+ + Сl- = AgCl↓
Проведите эту реакцию, приливая по 2-3 капли соответствующих реактивов. Разделите осадок на две части и проверьте действие на него избытка кислот и аммиака.
Бромид и иодид калия  и
и 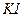 образуют с ионами серебра бледно- желтый осадок бромида серебра
образуют с ионами серебра бледно- желтый осадок бромида серебра 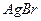 и желтый осадок иодида серебра
и желтый осадок иодида серебра  :
:

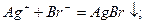
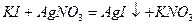




Проведите эти реакции, приливая по 2-3 капли соответствующих реактивов.
Бромид серебра в аммиаке труднорастворим, а иодид серебра практически нерастворим (в отличие от хлорида серебра), зато оба соединения растворяются в избытке цианида калия и тиосульфата натрия, а  - в избытке
- в избытке 



Гидроксид аммония при добавлении по каплям к концентрированному раствору  образует бурый осадок
образует бурый осадок  , растворимый в избытке реактива с образованием комплексного аммиаката серебра:
, растворимый в избытке реактива с образованием комплексного аммиаката серебра:


Комплекс легко разрушается действием 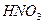 , при этом снова образуется осадок:
, при этом снова образуется осадок:
 .
.
2.2 Частные реакции на катион ртути 
Внимание! Все соединения ртути ядовиты. Работы со ртутью проводите с минимальным количеством вещества, все остатки сливайте в специальную посуду для нейтрализации.
Едкие щелочи 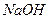 и
и 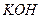 образуют с ионами
образуют с ионами  черный осадок закиси ртути
черный осадок закиси ртути 

Осадок растворяется в азотной и концентрированной уксусной кислотах.
Гидроксид аммония 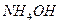 образует с ионами
образует с ионами  черный осадок, состоящий из смеси амидонитрата ртути (II)
черный осадок, состоящий из смеси амидонитрата ртути (II)  белого цвета и металлической ртути черного цвета:
белого цвета и металлической ртути черного цвета:

Восстановление  до металлической ртути. Если поместить каплю раствора
до металлической ртути. Если поместить каплю раствора 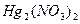 на блестящую медную пластинку (или монету) и дать постоять, то на пластинке образуется серое пятно металлической ртути:
на блестящую медную пластинку (или монету) и дать постоять, то на пластинке образуется серое пятно металлической ртути:
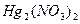 +
+ 
Если смыть раствор водой и пятно протереть тряпкой или фильтровальной бумагой, оно становится блестящим.
|
|
|
2.3 Частные реакции на катион свинца 
Свинец имеет четыре валентных электрона и проявляет переменную валентность. Соответственно своему положению в периодической системе он имеет максимальную валентность, равную четырем, однако, за исключением диоксида свинца и некоторых комплексных соединений, соединения Pb4+ неустойчивы. Более устойчивы, в частности, в природных объектах, соединения двухвалентного свинца. Все соединения свинца ядовиты.
Гидроксиды  образуют с катионами
образуют с катионами  белый осадок
белый осадок 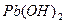 :
:

Осадок обладает амфотерностью, т.е. растворяется в кислотах и щелочах:

В 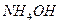 осадок не растворяется.
осадок не растворяется.
Серная кислота и сульфаты осаждают катионы свинца в виде белого кристаллического осадка 

Осадок при нагревании растворяется в избытке 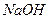 или
или 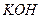 с образованием плюмбитов:
с образованием плюмбитов:

Сульфат свинца растворяется в горячем растворе уксуснокислого аммония:

а также растворяется в концентрированной соляной и серной кислотах с образованием комплексных солей:

Иодистый калий 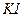 образует с ионами свинца желтый осадок
образует с ионами свинца желтый осадок  несколько растворимый в избытке реактива (с образованием комплекса
несколько растворимый в избытке реактива (с образованием комплекса  ) и в горячей воде:
) и в горячей воде:

Если осадок растворить в горячей воде с несколькими каплями 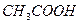 , а затем раствор охладить, то выпадают кристаллы золотисто-желтого цвета; реакция позволяет открыть ионы свинца в присутствии катионов всех аналитических групп.
, а затем раствор охладить, то выпадают кристаллы золотисто-желтого цвета; реакция позволяет открыть ионы свинца в присутствии катионов всех аналитических групп.
Хромат калия  и дихромат калия
и дихромат калия  образуют труднорастворимый желтый осадок хромата свинца
образуют труднорастворимый желтый осадок хромата свинца  :
:


Осадок не растворим в 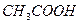 , 2М
, 2М 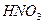 и в
и в 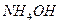 , но растворяется в более концентрированной азотной кислоте и в щелочах.
, но растворяется в более концентрированной азотной кислоте и в щелочах.
|
|
|


