 |
Третья аналитическая группа катионов
|
|
|
|
К третьей группе относятся катионы щелочноземельных элементов Ba2+, Sr2+, Ca2+. Их атомы имеют по два электрона на внешней оболочке и легко их отдают, вступая в реакции, с образованием двухвалентных ионов. Сульфат-ион с этими катионами образует осадки, т.е. разбавленная серная кислота является групповым реагентом:

Все эти осадки нерастворимы ни в щелочах, ни в кислотах, но обладают различной растворимостью в воде: растворимость сульфата бария в ней равна 0,0025 г/л, сульфата стронция – 0,097 г/л и сульфата кальция - 2,0 г/л. Следовательно, при взаимодействии сульфат-ионов с катионами  и
и 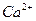 первые два из них осаждаются в виде сульфатов (
первые два из них осаждаются в виде сульфатов ( и
и 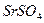 ) практически полностью, а катионы кальция при этом в значительной мере остаются в растворе. В отличие от
) практически полностью, а катионы кальция при этом в значительной мере остаются в растворе. В отличие от  и
и 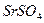 растворимость сульфата кальция повышается в присутствии сульфата аммония. При этом образуется очень неустойчивая комплексная соль:
растворимость сульфата кальция повышается в присутствии сульфата аммония. При этом образуется очень неустойчивая комплексная соль:

В присутствии спирта (метилового или этилового), а также ацетона растворимость 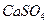 очень сильно понижается. Если осаждение катионов кальция серной кислотой производить в водном растворе с добавлением к нему 50-60% спирта или ацетона, то они при этом полностью перейдут в осадок.
очень сильно понижается. Если осаждение катионов кальция серной кислотой производить в водном растворе с добавлением к нему 50-60% спирта или ацетона, то они при этом полностью перейдут в осадок.
Указанные выше различия в растворимости в воде сульфатов бария, стронция и кальция и изменение растворимости 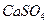 в присутствии
в присутствии 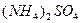 и спирта (или ацетона) широко используются при открытии катионов
и спирта (или ацетона) широко используются при открытии катионов  и
и 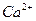 из их растворов.
из их растворов.
Для растворения сульфатов Ba2+, Sr2+, Ca2+ их вначале переводят в карбонаты кипячением с избытком карбоната натрия или калия:
BaSO4↓ + Na2CO3 = BaCO3↓ + Na2SO4
Произведения растворимости этих осадков близки (ПР(BaCO3) = 5,1.10-9, ПР(BaSO4) = 1,1.10-10), поэтому для более полного превращения требуется 2-3-кратная обработка осадка свежими порциями карбоната натрия с удалением раствора сульфата натрия. Далее осадки карбонатов Ba2+, Sr2+, Ca2+ легко растворяются в соляной или азотной кислоте.
|
|
|
Проведите частные реакции на ионы третьей аналитической группы, отметьте вид и цвет осадков, изучите их свойства.
3.1 Частные реакции на катион бария 
Барий - один из активнейших щелочноземельных металлов, он легко разлагает воду с образованием сильного основания Ba(OH)2, энергично растворяется в кислотах. Большинство растворимых в воде его соединений являются ядовитыми веществами.
Растворимы в воде следующие соли бария: галогениды, нитрат, ацетат и роданид. Из нерастворимых солей важное значение в анализе имеют: карбонат, сульфат, хромат, оксалат, фосфат, сульфид, фторид, ферроцианид.
Хромат калия  образует с ионами
образует с ионами  бледно - желтый кристаллический осадок хромата бария:
бледно - желтый кристаллический осадок хромата бария:

Осадок  не растворим в уксусной кислоте, но растворим в соляной и азотной кислотах:
не растворим в уксусной кислоте, но растворим в соляной и азотной кислотах:

Ионы  с
с  также образуют осадок
также образуют осадок  , но в отличии от
, но в отличии от  , растворимый в уксусной кислоте. Ионы
, растворимый в уксусной кислоте. Ионы 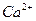 с
с  осадка не дают.
осадка не дают.
Дихромат калия  образует с ионами
образует с ионами  желтый осадок хромата бария:
желтый осадок хромата бария:

Эта реакция отчасти обратима, т.к. осадок  растворяется в образовавшейся соляной кислоте. Для достижения полноты осаждения связывают соляную кислоту добавлением ацетата натрия (или ацетатной буферной смеси):
растворяется в образовавшейся соляной кислоте. Для достижения полноты осаждения связывают соляную кислоту добавлением ацетата натрия (или ацетатной буферной смеси):

При этом вместо сильной кислоты 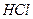 образуется слабая
образуется слабая 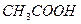 , в которой осадок
, в которой осадок  не растворим.
не растворим.
3.2 Частные реакции на катион стронция 
Стронций в свободном состоянии во влажном воздухе быстро окисляется; разлагает воду и бурно растворяется в кислотах. Он содержится во многих горных породах (совместно с кальцием), в очень малых количествах в различных тканях живого организма, в основном в костях и зубах. В лабораторной практике используются следующие растворимые соли стронция:  Из нерастворимых солей имеют значение в анализе:
Из нерастворимых солей имеют значение в анализе: 
|
|
|
Гипсовая вода (насыщенный раствор гипса  ) вызывает образование мути не сразу, а после некоторого стояния или кипячения. Соли кальция с гипсовой водой осадка не дают, а соли бария дают осадок тотчас после приливания реактива. Этот признак различного отношения солей стронция и бария к гипсовой воде имеет важное значение для качественных реакций на стронций и барий:
) вызывает образование мути не сразу, а после некоторого стояния или кипячения. Соли кальция с гипсовой водой осадка не дают, а соли бария дают осадок тотчас после приливания реактива. Этот признак различного отношения солей стронция и бария к гипсовой воде имеет важное значение для качественных реакций на стронций и барий:

Сернокислый стронций не растворим в соляной, азотной и уксусной кислотах.
Оксалат аммония  осаждает катион
осаждает катион  в виде белого осадка:
в виде белого осадка:
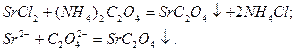
Оксалат стронция легко растворяется в минеральных кислотах и незначительно в уксусной кислоте при кипячении; оксалат кальция в уксусной кислоте вообще нерастворим (важный аналитический признак!).
Окрашивание пламени. Летучие соли стронция окрашивают бесцветное пламя горелки в карминово-красный цвет.
3.3 Частные реакции на катион 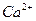
Кальций в свободном состоянии устойчив только в отсутствии влаги. Разлагает воду с образованием основания средней силы Са(ОН)2 и бурно растворяется в кислотах. Содержание различных солей кальция в воде обуславливает её “жесткость”. Растворимые соли кальция:  К числу нерастворимых соединений относятся:
К числу нерастворимых соединений относятся:  и другие.
и другие.
Оксалат аммония  и другие растворимые соли щавелевой кислоты осаждают из нейтральных, уксуснокислых и щелочных растворов солей кальция кристаллический осадок
и другие растворимые соли щавелевой кислоты осаждают из нейтральных, уксуснокислых и щелочных растворов солей кальция кристаллический осадок  , растворимый в минеральных кислотах:
, растворимый в минеральных кислотах:

Реакция образования оксалата кальция принадлежит к числу самых чувствительных реакций на ион кальция.
Микрокристаллоскопическая реакция. На предметное стекло помещают каплю раствора соли кальция, действуют каплей 2н.  и слегка упаривают до появления каемки по краям капли. Образовавшиеся игольчатые кристаллы (в виде пучков или звездочек) гипса
и слегка упаривают до появления каемки по краям капли. Образовавшиеся игольчатые кристаллы (в виде пучков или звездочек) гипса  рассматривают под микроскопом.
рассматривают под микроскопом.
Этой реакцией можно открыть кальций в присутствии ионов  и
и  , так как последние характерных крупных кристаллов сульфатов не образуют. Можно вначале отделить ионы
, так как последние характерных крупных кристаллов сульфатов не образуют. Можно вначале отделить ионы  и
и  в виде осадка сульфатов, а раствор отфильтровать, упарить и наблюдать появление кристаллов гипса.
в виде осадка сульфатов, а раствор отфильтровать, упарить и наблюдать появление кристаллов гипса.
Окрашивание пламени.
Летучие соли кальция ( ) окрашивают бесцветное пламя горелки в кирпично - красный цвет.
) окрашивают бесцветное пламя горелки в кирпично - красный цвет.
|
|
|
|
|
|


