 |
Шестая аналитическая группа катионов
|
|
|
|
К шестой аналитической группе относятся катионы  ,
, 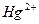 ,
, 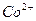 . Хотя элементы их расположены в разных группах периодической системы Д. И. Менделеева – медь в первой, кадмий и ртуть во второй, кобальт и никель в восьмой, все эти катионы характеризуются способностью к комплексообразованию. Их гидроксиды растворяются в избытке аммиака с образованием аминокомплексов различного состава. Гидроксиды
. Хотя элементы их расположены в разных группах периодической системы Д. И. Менделеева – медь в первой, кадмий и ртуть во второй, кобальт и никель в восьмой, все эти катионы характеризуются способностью к комплексообразованию. Их гидроксиды растворяются в избытке аммиака с образованием аминокомплексов различного состава. Гидроксиды  с катионами
с катионами  дают аморфные осадки гидроксидов, с катионами
дают аморфные осадки гидроксидов, с катионами 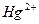 - оксиды, с
- оксиды, с 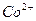 - основные соли:
- основные соли:

Все эти осадки растворимы в кислотах, а также избытке аммиака с образованием аминокомплексов (HgO растворяется только в 25% NH3 при добавлении солей аммония).
6.1 Частные реакции на катион Cu2+:
Водный раствор аммиака при взаимодействии с ионами меди сначала осаждает основные соли переменного состава зеленого цвета, легкорастворимые в избытке реагента. При рН > 9 образуются аммиачные комплексы меди интенсивно-синего цвета. Предел обнаружения меди – 40 мкг.
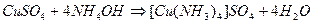
Выполнение реакции: К 2-3 каплям раствора, содержащего ионы меди (II), добавляют избыток раствора аммиака до рН>9. Появление интенсивно-синей окраски указывает на присутствие меди. Эту реакцию удобно использовать для открытия Сu2+ в присутствии катионов всех групп.
Дитизон при рН 1-4 с  образует внутрикомплексное соединение красно-фиолетового цвета, экстрагируемое
образует внутрикомплексное соединение красно-фиолетового цвета, экстрагируемое 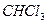 и
и 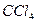 . Предел обнаружения меди – 0,1 мкг. Мешают
. Предел обнаружения меди – 0,1 мкг. Мешают  и
и  Если в качестве маскирующего реагента использовать
Если в качестве маскирующего реагента использовать 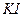 при рН 1-2, то медь можно обнаружить с дитизоном без помех со стороны других ионов металлов.
при рН 1-2, то медь можно обнаружить с дитизоном без помех со стороны других ионов металлов.
Выполнение реакции: К 1-2 каплям анализируемого раствора с рН 1-2 прибавляют 5-6 капель 5%-ного раствора 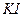 и экстрагируют 0,02%-ным раствором реагента в
и экстрагируют 0,02%-ным раствором реагента в 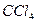 . В присутствии меди органический слой окрашивается в красно-фиолетовый цвет.
. В присутствии меди органический слой окрашивается в красно-фиолетовый цвет.
|
|
|
Металлические алюминий, железо, цинк восстанавливают катион меди до свободного металла, имеющего вид красной губчатой массы:
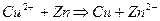
Гексациано(II)феррат калия при рН ≤ 7 осаждает ионы меди в виде красно-бурого осадка  , растворимого в аммиаке с образованием аммиакатов меди. Предел обнаружения меди – 10 мкг. Мешают ионы
, растворимого в аммиаке с образованием аммиакатов меди. Предел обнаружения меди – 10 мкг. Мешают ионы 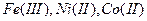 , образующие с реагентом цветные осадки. Поэтому их предварительно отделяют или связывают в устойчивые растворимые комплексные соединения. При очень малых концентрациях меди осадок не выпадает, но раствор окрашивается в розовый цвет.
, образующие с реагентом цветные осадки. Поэтому их предварительно отделяют или связывают в устойчивые растворимые комплексные соединения. При очень малых концентрациях меди осадок не выпадает, но раствор окрашивается в розовый цвет.
Выполнение реакции: К 2-3 каплям раствора, содержащего ионы меди (II) (рН ≤ 7), прибавляют 1-2 капли раствора реагента. Образуется красно-бурый осадок.
6.2 Частные реакции на катион Hg2+
Сероводород и 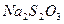 в кислой среде с солями ртути (II) при нагревании дают черный осадок сульфида ртути.
в кислой среде с солями ртути (II) при нагревании дают черный осадок сульфида ртути.
HgCl2 + H2S Þ HgS¯ + 2HCl
Чёрный 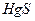 при нагревании или при действии щелочных растворов полисульфидов превращается в красную форму; сульфид ртути растворим в царской водке; в смесях
при нагревании или при действии щелочных растворов полисульфидов превращается в красную форму; сульфид ртути растворим в царской водке; в смесях 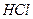 и
и  ;
; 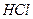 и
и 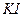 .
.
Предел обнаружения ртути в сильнокислых растворах – 10 мкг. Из 6-7 М 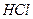 вместе со ртутью осаждаются сульфиды мышьяка (V) и меди (II).
вместе со ртутью осаждаются сульфиды мышьяка (V) и меди (II).
Выполнение реакции: К 2-3 каплям раствора, содержащего ионы ртути (II), добавляют 3-4 капли концентрированной 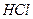 , 3-4 капли раствора сульфида аммония и нагревают в водяной бане. Образуется чёрный осадок
, 3-4 капли раствора сульфида аммония и нагревают в водяной бане. Образуется чёрный осадок 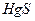 . Осадок центрифугируют, часть его переносят в другую пробирку и растворяют в царской водке; оставшуюся часть осадка растворяют в смеси
. Осадок центрифугируют, часть его переносят в другую пробирку и растворяют в царской водке; оставшуюся часть осадка растворяют в смеси 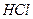 и
и 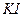 .
.
Иодид калия при взаимодействии с ионами ртути (II) осаждает красный осадок  , растворимый в избытке реагента:
, растворимый в избытке реагента:

Имеются две модификации  : красная и желтая. Красная модификация при нагревании до 150 0С переходит в жёлтую. Иодид ртути растворяется в тиосульфате с образованием устойчивых комплексных ионов типа
: красная и желтая. Красная модификация при нагревании до 150 0С переходит в жёлтую. Иодид ртути растворяется в тиосульфате с образованием устойчивых комплексных ионов типа  . При более высоких содержаниях ртути в растворе образуются полиядерные комплексные соединения. Если в растворе присутствует несколько анионов разных по природе, то образуются смешаннолигандные комплексы
. При более высоких содержаниях ртути в растворе образуются полиядерные комплексные соединения. Если в растворе присутствует несколько анионов разных по природе, то образуются смешаннолигандные комплексы  , например
, например 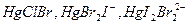 и др. При действии
и др. При действии 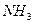 или ионов аммония и концентрированного раствора щелочи на раствор, содержащий комплексные ионы
или ионов аммония и концентрированного раствора щелочи на раствор, содержащий комплексные ионы  , выпадает характерный красно-бурый осадок:
, выпадает характерный красно-бурый осадок:
|
|
|
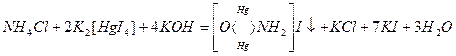
Эту реакцию, называемую реакцией Несслера, используют для обнаружения 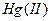 и
и 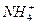 . Предел обнаружения ртути – 5 мкг.
. Предел обнаружения ртути – 5 мкг.
Выполнение реакции: К 1-2 каплям раствора, содержащего ионы ртути (II), добавляют раствор 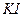 по каплям до образования
по каплям до образования  и избыток до растворения осадка и образования
и избыток до растворения осадка и образования  . К полученному раствору добавляют 1-2 капли раствора
. К полученному раствору добавляют 1-2 капли раствора 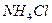 и 1-2 капли 30%-ного раствора
и 1-2 капли 30%-ного раствора 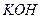 . Образуется красно-бурый осадок.
. Образуется красно-бурый осадок.
Иодид меди (I). Для обнаружения ионов ртути (II) можно использовать реакцию:

Предел обнаружения ртути – 2 мкг. Влияние мешающих веществ легко устранить. Ионы  и
и  удаляют осаждением
удаляют осаждением 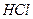 . Молибдаты и вольфраматы, образующие оксиды синего цвета при взаимодействии с
. Молибдаты и вольфраматы, образующие оксиды синего цвета при взаимодействии с  , устраняют добавлением фторид-ионов; окисление
, устраняют добавлением фторид-ионов; окисление  ионами
ионами  предотвращают маскированием
предотвращают маскированием  фосфат- или фторид-ионами.
фосфат- или фторид-ионами.
Выполнение реакции: На капельную пластинку или фильтровальную бумагу капилляром наносят по капле 5%-ного раствора 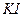 , 20%-ного раствора
, 20%-ного раствора 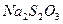 , затем добавляют каплю 5%-ного раствора
, затем добавляют каплю 5%-ного раствора  в 1 М
в 1 М 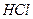 и каплю анализируемого раствора в 1 М
и каплю анализируемого раствора в 1 М 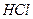 или
или 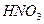 . В зависимости от количества присутствующей ртути появляется красное или оранжевое окрашивание.
. В зависимости от количества присутствующей ртути появляется красное или оранжевое окрашивание.
Дитизон в растворах минеральных кислот образует с ионами 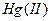 внутрикомплексное соединение оранжевого цвета, экстрагируемое
внутрикомплексное соединение оранжевого цвета, экстрагируемое 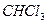 и
и 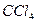 . Предел обнаружения ртути – 1 мкг. Мешают ионы серебра. Для их удаления экстракт встряхивают с 1 М
. Предел обнаружения ртути – 1 мкг. Мешают ионы серебра. Для их удаления экстракт встряхивают с 1 М 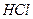 .
.
Выполнение реакции: К 1-2 каплям исследуемого раствора добавляют 1-2 капли 6 М  и экстрагируют 0,002%-ным раствором реагента в
и экстрагируют 0,002%-ным раствором реагента в 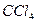 . В присутствии ртути (II) органический слой окрашивается в оранжевый цвет. Если в анализируемом растворе присутствует
. В присутствии ртути (II) органический слой окрашивается в оранжевый цвет. Если в анализируемом растворе присутствует  , органическую фазу встряхивают с 1 М
, органическую фазу встряхивают с 1 М 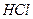 .
.
6.3 Частные реакции на катион Cd2+.
Сероводород или сульфиды щелочных металлов в уксуснокислой среде образуют с ионами кадмия жёлтый осадок сульфида кадмия. Осадок не растворим в сульфиде и гидроксиде натрия, но растворим в концентрированных 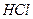 и
и 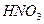 :
:
|
|
|


Все остальные катионы VI группы и окислители мешают определению  .
.
Тиомочевина образует с солями кадмия легкорастворимые комплексные соли:

Комплексные соли кадмия легко разлагаются сероводородом даже при избытке тиомочевины. Комплексы других катионов устойчивы. В присутствии катиона  выпадает жёлто-оранжевый осадок. Эта реакция позволяет открыть катион
выпадает жёлто-оранжевый осадок. Эта реакция позволяет открыть катион  в присутствии катиона
в присутствии катиона 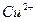 , который даёт растворимый тиомочевинный комплекс.
, который даёт растворимый тиомочевинный комплекс.
Дитизон взаимодействует с ионами кадмия в интервале рН 6,5-14 с образованием красного внутрикомплексного соединения, экстрагируемого 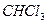 и
и 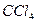 . Предел обнаружения кадмия – 0,5 мкг; мешающее влияние большинства ионов металлов устраняют добавлением тартратов и диметилглиоксима. В этом случае мешают только
. Предел обнаружения кадмия – 0,5 мкг; мешающее влияние большинства ионов металлов устраняют добавлением тартратов и диметилглиоксима. В этом случае мешают только  , их удаляют предварительной экстракцией раствором дитизона в
, их удаляют предварительной экстракцией раствором дитизона в 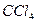 при рН 1-2.
при рН 1-2.
Выполнение реакции: К 2-3 каплям исследуемого раствора прибавляют 2 М 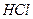 до рН 1-2 и экстрагируют насыщенным раствором дитизона в
до рН 1-2 и экстрагируют насыщенным раствором дитизона в 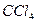 . После разделения фаз к водной фазе добавляют 2-3 капли 20%-ного раствора тартрата калия-натрия, 1-2 капли 1%-ного раствора диметилглиоксима и 30%-ный раствор
. После разделения фаз к водной фазе добавляют 2-3 капли 20%-ного раствора тартрата калия-натрия, 1-2 капли 1%-ного раствора диметилглиоксима и 30%-ный раствор 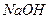 до рН 9-10 и экстрагируют 0,002%-ным раствором реагента в
до рН 9-10 и экстрагируют 0,002%-ным раствором реагента в 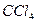 . В присутствии кадмия органический слой окрашивается в красный цвет.
. В присутствии кадмия органический слой окрашивается в красный цвет.
6.4 Частные реакции на катион Co 2+
Катион Со2+ имеет в водных растворах розово-фиолетовую окраску.
Роданид аммония (или калия) 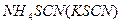 в уксуснокислом растворе при рН 4-5 с ионами кобальта (II) образует окрашенные в синий цвет комплексные соединения различного состава общей формулы
в уксуснокислом растворе при рН 4-5 с ионами кобальта (II) образует окрашенные в синий цвет комплексные соединения различного состава общей формулы 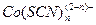 , где
, где 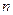 =1, 2, 3. Кислородсодержащие растворители (эфир, ацетон, изоамиловый спирт) экстрагируют темно-синие малоустойчивые комплексы кобальта, по-видимому, состава
=1, 2, 3. Кислородсодержащие растворители (эфир, ацетон, изоамиловый спирт) экстрагируют темно-синие малоустойчивые комплексы кобальта, по-видимому, состава  . Для понижения диссоциации комплексных соединений необходимо вводить большой избыток тиоцианата.
. Для понижения диссоциации комплексных соединений необходимо вводить большой избыток тиоцианата.
CoCl2 + 4(NH4)2SCN Û (NH4)2[Co(SCN)4] + 2NH4Cl
Co2+ + 4SCN- Û [Co(SCN)4]2-
Предел обнаружения кобальта – 3 мкг. Мешают ионы железа (III), которые маскируют добавлением фторид – ионов.
|
|
|
Выполнение реакции: К 2-3 каплям раствора, содержащего ионы кобальта (II), добавляют твёрдый тиоцианат аммония (калия), твёрдый фторид аммония, 5-7 капель изоамилового спирта и встряхивают. Слой изоамилового спирта окрашивается в синий цвет.
Открытию катиона Co2+ может мешать присутствие катионов Cu2+, Fe3+, Bi3+. Поэтому в присутствии катионов всех аналитических групп открытие катиона Co2+ проводят следующим образом. На полоску фильтровальной бумаги нанесите каплю концентрированного раствора роданида аммония, а на полученное пятно 1 каплю испытуемого раствора, затем бумажку подержите в парах аммиака (над горлышком склянки с концентрированным раствором аммиака) и подсушите над пламенем горелки. Если есть катион Co2+, то пятно окрашивается в интенсивно-синий цвет.
Тетрародано(II)меркурат аммония (микрокристаллоскопическая реакция). При действии на раствор соли кобальта (II) раствора (NH4)2[Hg(SCN)4] образуются ярко-синие кристаллы малорастворимого соединения  Ускорению выпадения осадка способствует присутствие катиона
Ускорению выпадения осадка способствует присутствие катиона  (реакцию проводят в присутствии серной кислоты):
(реакцию проводят в присутствии серной кислоты):

Мешают проведению реакции катионы  Предел обнаружения кобальта – 0,1 мкг. Ионы
Предел обнаружения кобальта – 0,1 мкг. Ионы  осаждаются реагентом, однако синие розетки или иглы кристаллов соединения кобальта различимы под микроскопом даже в присутствии значительных количеств посторонних ионов. Ионы железа (III) маскируют фторид-ионами.
осаждаются реагентом, однако синие розетки или иглы кристаллов соединения кобальта различимы под микроскопом даже в присутствии значительных количеств посторонних ионов. Ионы железа (III) маскируют фторид-ионами.
Выполнение реакции: На предметное стекло помещают каплю раствора, содержащего ионы кобальта и ионы цинка, рядом помещают каплю раствора реагента, соединяют капли стеклянной палочкой. Наблюдают образование синих кристаллов и рассматривают их под микроскопом.
Нитрит калия в уксуснокислом растворе при рН 4-5 образует с ионами кобальта (II) жёлтый осадок, в котором кобальт имеет степень окисления III:
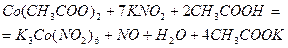
В разбавленных растворах осадок образуется при нагревании и стоянии. Эту реакцию используют для отделения кобальта от мешающих ионов. Предел обнаружения кобальта – 0,4 мкг.
Выполнения реакции. К 2-3 каплям раствора, содержащего ионы кобальта (II), добавляют 2 капли 2 М 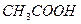 , 2 капли раствора
, 2 капли раствора 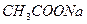 и твёрдый
и твёрдый  . Смесь нагревают несколько минут на водяной бане. Образуется жёлтый осадок.
. Смесь нагревают несколько минут на водяной бане. Образуется жёлтый осадок.
6.5 Частные реакции на катион Ni 2+
Реактив Чугаева – диметилглиоксим в аммиачной среде при рН = 6-9

Реакция очень чувствительная, открываемый минимум – 0,16 мкг. Сначала раствор окрашивается в интенсивный розовый цвет, а затем образуется красный осадок внутрикомплексной соли – диметилглиоксимата никеля.
С диметилглиоксимом образуют комплексные соединения также  (оранжево-жёлтого цвета),
(оранжево-жёлтого цвета),  (красноватого цвета),
(красноватого цвета), 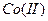 (коричнево-красного цвета). Если предварительно окислить
(коричнево-красного цвета). Если предварительно окислить  до
до  и
и 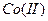 до
до  , никель можно обнаружить в присутствии 200-кратных количеств этих элементов. При обнаружении никеля в аммиачных растворах в присутствии ионов металлов, образующих окрашенные гидроксиды, добавляют цитраты и тартраты для предотвращения выпадения гидроксидов. Ионы
, никель можно обнаружить в присутствии 200-кратных количеств этих элементов. При обнаружении никеля в аммиачных растворах в присутствии ионов металлов, образующих окрашенные гидроксиды, добавляют цитраты и тартраты для предотвращения выпадения гидроксидов. Ионы 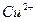 и
и 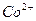 мешают определению катиона
мешают определению катиона 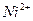 .
.
|
|
|
Выполнение реакции.
1) К 1-2 каплям раствора, содержащего 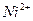 , добавляют 1-2 капли 1%-ного этанольного раствора диметилглиоксима и 1-2 капли 2 М
, добавляют 1-2 капли 1%-ного этанольного раствора диметилглиоксима и 1-2 капли 2 М 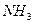 . Образуется характерный ало-красный осадок.
. Образуется характерный ало-красный осадок.
2) Обнаружение в присутствии ионов  ,
, 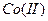 и
и  . На бумагу, пропитанную диметилглиоксимом, наносят последовательно каплю исследуемого раствора, каплю насыщенного раствора тартрата натрия. Затем бумагу погружают в разбавленный раствор аммиака, где её осторожно приводят в движение. Окрашенные диметилглиоксиматы кобальта и меди растворяются, на бумаге остаётся красное пятно диметилглиоксимата никеля.
. На бумагу, пропитанную диметилглиоксимом, наносят последовательно каплю исследуемого раствора, каплю насыщенного раствора тартрата натрия. Затем бумагу погружают в разбавленный раствор аммиака, где её осторожно приводят в движение. Окрашенные диметилглиоксиматы кобальта и меди растворяются, на бумаге остаётся красное пятно диметилглиоксимата никеля.
3) К 1-2 каплям исследуемого раствора добавляют 1-2 капли 20%-ного раствора тартрата калия-натрия, кристаллик тиосульфата натрия, 1-2 капли 10%-ного раствора солянокислого гидроксиламина и раствором 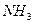 доводят рН до 9. Экстрагируют насыщенным раствором реагента в
доводят рН до 9. Экстрагируют насыщенным раствором реагента в 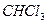 . Органическая фаза в присутствии никеля окрашивается в жёлтый цвет.
. Органическая фаза в присутствии никеля окрашивается в жёлтый цвет.
|
|
|


