 |
Четвёртая аналитическая группа катионов
|
|
|
|
К четвертой группе относятся катионы Al3+, Cr3+, Zn2+, As3+, As5+, Sn2+, Sn4+ (в зависимости от условий эти элементы в обозначенных степенях окисления могут входить и в состав анионов). Алюминий, находясь в начале третьего малого периода периодической системы Д. И. Менделеева, имеет законченные двух- и восьмиэлектронные слои внешней оболочки. Другие элементы размещены в средней части четвёртого большого периода, у них происходит достройка третьего электронного слоя от 8 до 18 электронов.
Хром является переходным элементом. Он находится в первой половине четвёртого периода, в конце чётного ряда и имеет несколько отличные свойства от всех остальных катионов этой группы. Он обладает выраженной способностью к комплексообразованию. Гидратированный гидроксид хрома по своим свойствам очень близок к гидратированному гидроксиду алюминия.
Цинк расположен во второй половине четвертого большого периода и имеет законченный 18-электронный слой.
Алюминий и цинк обладают постоянной, а остальные элементы переменной степенью окисления.
Групповой реагент – гидроксид натрия (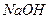 ) или калия (
) или калия (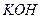 ), в избытке щелочей эти катионы образуют растворимые соли:
), в избытке щелочей эти катионы образуют растворимые соли:

Большинство солей катионов IV группы подвергаются гидролизу:

Вследствие этого при действии на соли Al3+, Cr3+, Sn2+, Sn4+ карбоната натрия выпадают осадки не карбонатов, а гидроксидов этих элементов.
4.1 Частные реакции на катион Al3+:
Раствор аммиака осаждает катион Al3+:
 ↓
↓
Гидроксид алюминия не растворяется в растворах солей аммония, но растворяется в щелочах. Алюминат растворяется в минеральной кислоте:

Ализарин (1,2-диоксиантрахинон  ) в аммиачной среде образует с
) в аммиачной среде образует с  труднорастворимое соединение ярко-красного цвета, называемое алюминиевым лаком. Предполагают, что осадок является адсорбционным соединением гидроксида алюминия и ализарина. Соединение образуется в результате химической адсорбции, т.е. ализарин или его анион взаимодействует с ионами алюминия на поверхности частичек геля гидроксида алюминия:
труднорастворимое соединение ярко-красного цвета, называемое алюминиевым лаком. Предполагают, что осадок является адсорбционным соединением гидроксида алюминия и ализарина. Соединение образуется в результате химической адсорбции, т.е. ализарин или его анион взаимодействует с ионами алюминия на поверхности частичек геля гидроксида алюминия:
|
|
|


гель лак
Однако это взаимодействие не приводит к образованию AlR3 в качестве отдельной фазы. Ионы алюминия связывают ализарин, оставаясь в составе частичек геля.
Железо (III), хром (III), марганец (II) мешают определению алюминия, так как образуют окрашенные ализариновые лаки. Для их маскировки используют K4[Fe(CN)6], с которым мешающие ионы образуют нерастворимые в воде гексацианоферраты. Реакцию проводят капельным методом и в пробирке. При выполнении реакции капельным методом предел обнаружения алюминия – 0,15 мкг.
Выполнение реакции:
1. На фильтровальную бумагу наносят каплю раствора K4[Fe(CN)6], затем в центр влажного пятна наносят каплю раствора, содержащего ионы алюминия, прикасаясь к бумаге кончиком капилляра. Далее в то же место наносят каплю раствора ализарина и обрабатывают пятно газообразным аммиаком, помещая бумагу над отверстием склянки с концентрированным раствором аммиака. Образующееся фиолетовое пятно обрабатывают 2-3 каплями 1 М CH3COOH. Фиолетовая окраска реагента переходит в желтую и можно наблюдать красную окраску алюминиевого лака.
2. В пробирке к 2-3 каплям кислого раствора, содержащего ионы алюминия, добавляют 2-3 капли раствора ализарина, твёрдый ацетат натрия до слабокислой среды и нагревают. Выпадает красный хлопьевидный осадок.
Алюминон (аммонийная соль ауринтрикарбоновой кислоты) дает с катионом  нерастворимую в воде (но хорошо растворимую в органических растворителях) внутрикомплексную соль (лак), имеющую красную окраску. Этот комплекс не разрушается при действии аммиака или карбоната аммония. Предел обнаружения алюминия – 2 мкг. Большие количества фосфатов, оксалатов и фторидов повышают предел обнаружения. Определению мешают ионы Fe3+, Bi3+, которые необходимо удалить; образование окрашенных комплексов алюминона с хромом (III) или кальцием устраняют добавлением в раствор аммиака или карбоната аммония.
нерастворимую в воде (но хорошо растворимую в органических растворителях) внутрикомплексную соль (лак), имеющую красную окраску. Этот комплекс не разрушается при действии аммиака или карбоната аммония. Предел обнаружения алюминия – 2 мкг. Большие количества фосфатов, оксалатов и фторидов повышают предел обнаружения. Определению мешают ионы Fe3+, Bi3+, которые необходимо удалить; образование окрашенных комплексов алюминона с хромом (III) или кальцием устраняют добавлением в раствор аммиака или карбоната аммония.
|
|
|
Выполнение реакции: К 2-3 каплям раствора, содержащего ионы алюминия, добавляют 1-2 капли алюминона и нагревают на водяной бане. Затем добавляют раствор аммиака до запаха и 2-3 капли раствора карбоната аммония. Образуются хлопья алюминиевого лака. Реакцию проводят при рН= 8,5-9,5.
8-Оксихинолин образует с алюминием при рН 4,5-10 внутрикомплексное соединение. Оксихинолинат алюминия мало растворим в воде, но хорошо экстрагируется органическими растворителями ( cпирты, кетоны). Экстракты окрашены в жёлтый цвет и интенсивно флуоресцируют зелёным светом. Флуоресцентную реакцию без предварительной экстракции проводят капельным методом на фильтровальной бумаге. Предел обнаружения алюминия – 0,008 мкг. При экстракции оксихинолината алюминия – 0,004 мкг. Мешают
cпирты, кетоны). Экстракты окрашены в жёлтый цвет и интенсивно флуоресцируют зелёным светом. Флуоресцентную реакцию без предварительной экстракции проводят капельным методом на фильтровальной бумаге. Предел обнаружения алюминия – 0,008 мкг. При экстракции оксихинолината алюминия – 0,004 мкг. Мешают  , оксихинолинаты которых также флуоресцируют. Ионы
, оксихинолинаты которых также флуоресцируют. Ионы  при 100-кратном количестве тушат флуоресценцию оксихинолината алюминия. Однако
при 100-кратном количестве тушат флуоресценцию оксихинолината алюминия. Однако  можно отделить от большинства катионов экстракцией его оксихинолината при рН 9 в присутствии соответствующих маскирующих веществ (винная кислота, цианид калия, пероксид водорода и т.п.).
можно отделить от большинства катионов экстракцией его оксихинолината при рН 9 в присутствии соответствующих маскирующих веществ (винная кислота, цианид калия, пероксид водорода и т.п.).
Выполнение реакции:
1. На фильтровальную бумагу наносят каплю раствора, содержащего ионы алюминия, каплю ацетатного буферного раствора (рН 6,5 – 9,5) и каплю 0,03%-ного этанольного раствора оксихинолина. В присутствии алюминия влажное пятно в ультрафиолетовом свете имеет зелёное свечение.
2. В пробирку вводят 2 - 5 капель раствора соли алюминия, добавляют ацетатный буферный раствор до рН 6,5 – 9, затем 5-6 капель 1%-ного раствора оксихинолина в хлороформе, и закрыв пробирку пробкой, встряхивают в течение 1-2 минут. Органическая фаза в присутствии алюминия окрашивается в жёлтый цвет. Для более четкого обнаружения алюминия можно к экстракту добавить 1-2 капли раствора ализарина, образуется ализариновый лак красного цвета. В ультрафиолетовом свете наблюдают зелёное свечение органической фазы.
|
|
|
4.2 Частные реакции на катион Cr3+:
Хром имеет переменную валентность, поэтому образует 2 ряда устойчивых солей: соли Cr3+ и соли хромовой и дихромовой кислот.
Растворы солей, содержащие 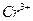 , имеют зеленую и фиолетовую, хромат-ион
, имеют зеленую и фиолетовую, хромат-ион  - желтую, дихромат-ион
- желтую, дихромат-ион  - оранжевую окраску.
- оранжевую окраску.
Гидроксид аммония образует с катионом Cr3+ осадок гидроксида хрома серо-зеленого (или серо-фиолетового) цвета:

Гидроксиды натрия или калия также образует с катионом Cr3+ осадок гидроксида хрома:

В избытке щелочи гидроксид хрома растворяется с образованием хромита натрия 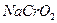 , имеющего ярко-зеленую окраску:
, имеющего ярко-зеленую окраску:


В отличие от алюмината натрия, в воде при нагревании 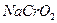 гидролизуется с образованием гидроксида хрома
гидролизуется с образованием гидроксида хрома  :
:

Это используется в анализе для разделения хрома и алюминия.
Реакции окисления катиона 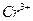 в
в  могут протекать в щелочной и кислой средах.
могут протекать в щелочной и кислой средах.
а) Окисление в щелочной среде можно проводить 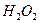 или
или  .
.
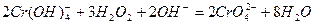
Образуется жёлтый раствор хромата натрия. Интересно, что при действии 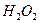 на растворы хроматов в зависимости от условий опыта образуются разнообразные пероксокомплексы хрома, например в кислой среде - голубой
на растворы хроматов в зависимости от условий опыта образуются разнообразные пероксокомплексы хрома, например в кислой среде - голубой  (
( молекулы воды или кислородсодержащего органического растворителя) и в нейтральной среде – фиолетовый, вероятно, состава
молекулы воды или кислородсодержащего органического растворителя) и в нейтральной среде – фиолетовый, вероятно, состава 

Пероксидные соединения хрома устойчивы в органических растворителях (диэтиловом эфире, амиловом спирте и др.); в водных растворах они неустойчивы:
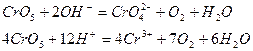
Предел обнаружения хрома – 10 мкг. Реакция практически селективна. Ванадий мешает обнаружению хрома при отношении 
Выполнение реакции: К 2-3 каплям раствора, содержащего ионы хрома (III), добавляют по каплям 2 М 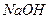 до образования осадка гидроксида хрома и далее до его растворения и образования гидроксокомплексов. Затем добавляют 1 каплю 30%-ного (или 6-8 капель 3%-ного) раствора
до образования осадка гидроксида хрома и далее до его растворения и образования гидроксокомплексов. Затем добавляют 1 каплю 30%-ного (или 6-8 капель 3%-ного) раствора  и нагревают. Образуется жёлтый раствор хромата. К части полученного раствора после охлаждения добавляют 1 каплю 3%-ного раствора
и нагревают. Образуется жёлтый раствор хромата. К части полученного раствора после охлаждения добавляют 1 каплю 3%-ного раствора  , несколько капель эфира и по каплям при встряхивании серную кислоту (1:4). Образующееся пероксидное соединение хрома экстрагируют эфиром, эфирный слой окрашивается в синий цвет.
, несколько капель эфира и по каплям при встряхивании серную кислоту (1:4). Образующееся пероксидное соединение хрома экстрагируют эфиром, эфирный слой окрашивается в синий цвет.
|
|
|
б) Превращение  в
в  в кислой среде.
в кислой среде.
Обнаружение хрома этой реакцией можно проводить в присутствии катионов всех аналитических групп. Окисление катиона 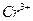 в кислой среде перманганатом калия
в кислой среде перманганатом калия  протекает до аниона
протекает до аниона  :
:


Окраска раствора переходит из малиновой в оранжевую.
Аналогично происходит окисление катионов 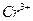 персульфатом аммония
персульфатом аммония  в кислой среде с образованием дихромат-иона
в кислой среде с образованием дихромат-иона  :
:
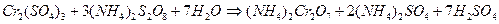

В пробирку налейте 5-6 капель раствора персульфата аммония, подкислите 1-2 каплями серной кислоты и добавьте 1 каплю раствора нитрата серебра (катализатор). Затем добавьте 2-3 капли сульфата или нитрата хрома (но не хлорида хрома!). После нагревания раствор становится оранжевым.
Условия проведения реакции:
1. Реакцию проводят в кислой среде при pH=1-2 (добавление серной кислоты).
2. Для ускорения реакции необходимо нагревать растворы.
3. Ионы-восстановители мешают проведению реакции.
Этилендиамитетраацетат натрия (ЭДТА) с ионами хрома (III) при рН 4-5 образует комплексное соединение фиолетового цвета состава  где
где  - анион ЭДТА:
- анион ЭДТА:








При комнатной температуре реакция идёт очень медленно, так как аквакомплексы  инертны, при нагревании скорость реакции увеличивается. При рН 7-9 образуются комплексы состава
инертны, при нагревании скорость реакции увеличивается. При рН 7-9 образуются комплексы состава  и фиолетовая окраска комплекса
и фиолетовая окраска комплекса 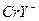 при подщелачивании раствора переходит в синюю:
при подщелачивании раствора переходит в синюю:

фиолетовая синяя
Окрашенные комплексные соединения ЭДТА образует также с  , поэтому они могут мешать обнаружению хрома (III).
, поэтому они могут мешать обнаружению хрома (III).
Так, ионы железа (III) образуют с ЭДТА более устойчивое, чем 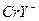 , комплексное соединение светло-жёлтого цвета и вследствие этого фиолетовая окраска
, комплексное соединение светло-жёлтого цвета и вследствие этого фиолетовая окраска 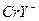 плохо видна. При больших избытках
плохо видна. При больших избытках 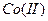 и
и  может появиться фиолетовая окраска, похожая на окраску комплексного соединения хрома. Обнаружению хрома мешают оксалат- и цитрат-ионы.
может появиться фиолетовая окраска, похожая на окраску комплексного соединения хрома. Обнаружению хрома мешают оксалат- и цитрат-ионы.
Выполнение реакции: К 3-4 каплям раствора, содержащего ионы хрома (III), добавляют 3-5 капель 30%-ного раствора 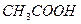 , 12-15 капель 5%-ного раствора ЭДТА (избыток ЭДТА обязателен), проверяют рН раствора (рН 4-5) и нагревают в водяной бане. В присутствии хрома (III) появляется фиолетовое окрашивание.
, 12-15 капель 5%-ного раствора ЭДТА (избыток ЭДТА обязателен), проверяют рН раствора (рН 4-5) и нагревают в водяной бане. В присутствии хрома (III) появляется фиолетовое окрашивание.
4.3. Частные реакции на катион Zn2+:
Раствор аммиака даёт с катионом  осадок белого цвета
осадок белого цвета  .
.

В избытке реагента  растворяется с образованием комплексного соединения
растворяется с образованием комплексного соединения 


Карбонаты щелочных металлов и аммония образуют белый осадок
основной соли:


Cероводород H2S образует с  белый осадок
белый осадок  :
:


Условия проведения реакции:
1. Реакция протекает лучше в уксуснокислой среде. В сильнокислой среде осадок не выпадает.
|
|
|
2. Присутствие окислителей мешает проведению реакции.
Гексациано(II)феррат калия 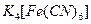 образует с
образует с  белый осадок двойной соли:
белый осадок двойной соли:


Дитизон (раствор дифенилтиокарбазона в хлороформе или в четырёххлористом углероде) даёт с  внутрикомплексную соль красного цвета. Это соединение в отличие от дитизонатов других катионов окрашивает в щелочной среде не только органическую, но и водную фазу в красный цвет. Предел обнаружения цинка – 1 мкг. Мешают ионы
внутрикомплексную соль красного цвета. Это соединение в отличие от дитизонатов других катионов окрашивает в щелочной среде не только органическую, но и водную фазу в красный цвет. Предел обнаружения цинка – 1 мкг. Мешают ионы  Их маскируют тиосульфатом, цианидом либо осаждают в виде сульфидов.
Их маскируют тиосульфатом, цианидом либо осаждают в виде сульфидов.
Выполнение реакции:
1) К 3-4 каплям раствора, содержащего ионы цинка, прибавляют 3-4 капли 2 М гидроксида натрия. Каплю полученного раствора наносят капилляром на фильтровальную бумагу. Пятно обводят по периферии капилляром с раствором дитизона в 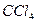 . Образуется характерное красное кольцо, которое сравнивают с контрольным опытом. Для этого рядом помещают на бумагу каплю 2 М
. Образуется характерное красное кольцо, которое сравнивают с контрольным опытом. Для этого рядом помещают на бумагу каплю 2 М 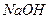 и также обводят по периферии капилляром с раствором дитизона в
и также обводят по периферии капилляром с раствором дитизона в 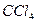 . Образуется оранжевое пятно.
. Образуется оранжевое пятно.
2) К 1-2 каплям исследуемого раствора прибавляют 1-2 капли 20%-ного раствора 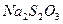 , 1-2 капли 10%-ного раствора
, 1-2 капли 10%-ного раствора  и доводят рН раствора до 4-5 20%-ным раствором
и доводят рН раствора до 4-5 20%-ным раствором 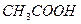 . Экстрагируют 0,02%-ным раствором дитизона в
. Экстрагируют 0,02%-ным раствором дитизона в 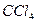 . В присутствии цинка органический слой окрашивается в красный цвет.
. В присутствии цинка органический слой окрашивается в красный цвет.
4.4 Частные реакции на катион Sn2+:
Сероводород в сильнокислой среде (2 М 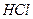 ) образует с ионами олова (II) осадок шоколадного цвета:
) образует с ионами олова (II) осадок шоколадного цвета:
 .
.
Предел обнаружения олова – 1,5 мкг.
Сульфид олова растворим в концентрированной 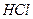 с образованием хлоридных комплексов; нерастворим в растворах сульфидов щелочных металлов и аммония. Это объясняется тем, что
с образованием хлоридных комплексов; нерастворим в растворах сульфидов щелочных металлов и аммония. Это объясняется тем, что  обладает основными свойствами. Однако он легко растворяется в полисульфиде аммония, который сначала окисляет
обладает основными свойствами. Однако он легко растворяется в полисульфиде аммония, который сначала окисляет  до
до  , а последний растворяется с образованием тиосолей:
, а последний растворяется с образованием тиосолей:

Выполнение реакции: К 2-3 каплям раствора, содержащего ионы олова (II), прибавляют 2-3 капли 2 М 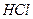 и пропускают
и пропускают 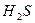 . Образуется осадок шоколадного цвета. Осадок отделяют и к нему добавляют несколько капель раствора
. Образуется осадок шоколадного цвета. Осадок отделяют и к нему добавляют несколько капель раствора  , осадок растворяется. К полученному раствору добавляют 2 М
, осадок растворяется. К полученному раствору добавляют 2 М 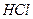 до кислой среды, выпадает золотисто-жёлтый осадок
до кислой среды, выпадает золотисто-жёлтый осадок  .
.
Хлорид ртути (II). Ионы олова (II) в солянокислой среде восстанавливают ионы 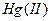 до
до 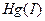 , при этом образуется белый осадок каломели
, при этом образуется белый осадок каломели  :
:
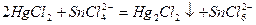
В избытке ионов олова (II) осадок каломели постепенно чернеет, так как 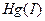 восстанавливается до металлической ртути. Предел обнаружения олова – 12,5 мкг.
восстанавливается до металлической ртути. Предел обнаружения олова – 12,5 мкг.
Выполнение реакции: К 2-3 каплям солянокислого раствора, содержащего ионы олова (II), добавляют 1 каплю раствора нитрата ртути (II). Выпадает белый шелковистый осадок  , который при стоянии постепенно чернеет.
, который при стоянии постепенно чернеет.
4.5 Частные реакции на катион Sn4+:
Металлические магний и железо восстанавливают  до
до  :
:


Ион  образуется в ходе реакции:
образуется в ходе реакции:
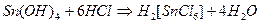
Выполнение реакции: К 2-3 каплям солянокислого раствора, содержащего ионы олова (IV), добавляют 1 каплю концентрированной 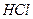 , железные опилки и нагревают до появления пузырьков. Затем раствор сливают в другую пробирку и добавляют 2 капли раствора
, железные опилки и нагревают до появления пузырьков. Затем раствор сливают в другую пробирку и добавляют 2 капли раствора  Выпадает белый шелковистый осадок
Выпадает белый шелковистый осадок  .
.
Диметилглиоксим с ионами олова (II) или олова (IV) в присутствии ионов железа (II) образует смешанное комплексное соединение  диметилглиоксим красного цвета, экстрагируемое бутанолом. Предел обнаружения олова – 10 мкг. Обнаружение возможно в присутствии больших количеств щелочных и щелочноземельных металлов, а также
диметилглиоксим красного цвета, экстрагируемое бутанолом. Предел обнаружения олова – 10 мкг. Обнаружение возможно в присутствии больших количеств щелочных и щелочноземельных металлов, а также  и 50-кратных количеств ионов
и 50-кратных количеств ионов  При избытке ионов
При избытке ионов  нужно прокипятить раствор с железными опилками до обесцвечивания раствора. Кобальт мешает определению олова, если его концентрация в исследуемом растворе больше, чем концентрация
нужно прокипятить раствор с железными опилками до обесцвечивания раствора. Кобальт мешает определению олова, если его концентрация в исследуемом растворе больше, чем концентрация  , так как в щелочной среде кобальт образует соединение с диметилглиоксимом. Если концентрация
, так как в щелочной среде кобальт образует соединение с диметилглиоксимом. Если концентрация  превышает концентрацию кобальта, олово хорошо обнаруживается.
превышает концентрацию кобальта, олово хорошо обнаруживается.
Выполнение реакции: К 2-3 каплям исследуемого раствора добавляют 3-5 капель 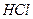 (1:1), железные опилки и нагревают до появления пузырьков воздуха. Металлическое железо восстанавливает
(1:1), железные опилки и нагревают до появления пузырьков воздуха. Металлическое железо восстанавливает  до
до  , в раствор переходят ионы
, в раствор переходят ионы  . Раствор отделяют от железных опилок, добавляют 3-5 капель 1%-ного раствора диметилглиоксима, 30%-ный раствор
. Раствор отделяют от железных опилок, добавляют 3-5 капель 1%-ного раствора диметилглиоксима, 30%-ный раствор 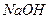 до щелочной среды и экстрагируют н-бутанолом. В присутствии олова органическая фаза окрашивается в красный цвет.
до щелочной среды и экстрагируют н-бутанолом. В присутствии олова органическая фаза окрашивается в красный цвет.
В случае избытка 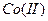 добавляют 2-3 капли раствора
добавляют 2-3 капли раствора  , чтобы
, чтобы  было больше, чем
было больше, чем 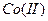 .
.
4.6 Частные реакции на катионы As3+ и As5+:
Раствор иода окисляет арсенит-ион  до арсенат-иона
до арсенат-иона  , при этом раствор иода обесцвечивается:
, при этом раствор иода обесцвечивается:

Выполнение реакции: В пробирку налейте 3-4 капли раствора арсенита натрия 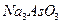 , прибавьте немного порошкообразного бикарбоната натрия, перемешайте стеклянной палочкой, затем добавьте 2-3 капли раствора иода. Обратите внимание на обесцвечивание раствора.
, прибавьте немного порошкообразного бикарбоната натрия, перемешайте стеклянной палочкой, затем добавьте 2-3 капли раствора иода. Обратите внимание на обесцвечивание раствора.
Для смещения равновесия в сторону образования ионов  необходимо связать ионы водорода при помощи гидрокарбоната натрия
необходимо связать ионы водорода при помощи гидрокарбоната натрия  . Раствор иода добавлять по каплям.
. Раствор иода добавлять по каплям. 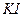 окисляется в кислой среде арсенат-анионами до свободного иода, окрашивающего в присутствии крахмала раствор в тёмно-синий цвет:
окисляется в кислой среде арсенат-анионами до свободного иода, окрашивающего в присутствии крахмала раствор в тёмно-синий цвет:

Условия проведения реакции:
1. Реакцию необходимо проводить в кислой среде при pH=2-3.
2. Для проведения реакции необходимо брать свежеприготовленный раствор 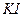 .
.
3. Водород в момент выделения восстанавливает  и
и  в мышьяковистый водород
в мышьяковистый водород  . Последующие взаимодействия мышьяковистого водорода с нитратом серебра и хлоридом ртути дают тёмное пятно металлического серебра или ртути.
. Последующие взаимодействия мышьяковистого водорода с нитратом серебра и хлоридом ртути дают тёмное пятно металлического серебра или ртути.
|
|
|


