 |
3. Смеси идеальных газов. Уравнение состояния отдельной компоненты газа в смеси. Уравнение состояния смеси. Теплоемкость смеси идеальных газов
|
|
|
|
3. Смеси идеальных газов
Физической моделью идеального газа, приводящей к уравнению Менделеева - Клапейрона, является система материальных точек, взаимодействующих только путем упругих соударений; другие механизмы взаимодействия отсутствуют. В отсутствие химического взаимодействия смесь одноатомных или многоатомных идеальных газов также является идеальным газом, для которого справедливо уравнение Менделеева-Клапейрона.
Уравнение состояния отдельной компоненты газа в смеси
Ввиду отсутствия сил взаимодействия каждый газ «не чувствует» присутствия других компонент смеси и занимает весь объем сосуда (Vсм). В силу термодинамической равновесности температура (T) компонент и смеси одна и та же. Следовательно, давление (Pj), оказываемое на стенки сосуда только j-й компонентой k-компонентной смеси, определяется из уравнения
 (3. 1)
(3. 1)
Здесь nj – количество киломолей j-й компоненты в смеси. Эти давления называют парциальными.
Уравнение состояния смеси
В соответствии с законом Дальтона (закон парциальных давлений) полное давление рассматриваемой смеси газов равно сумме парциальных давлений:
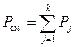 .
.
Суммируя отдельно левые и правые части уравнений (3. 1) по j, получим

Здесь  – масса смеси; Mj/Mсм=gj – массовая доля j-й компоненты в смеси. Это и есть уравнение состояния смеси идеальных газов (Менделеева-Клапейрона). С учетом закона Дальтона оно имеет вид
– масса смеси; Mj/Mсм=gj – массовая доля j-й компоненты в смеси. Это и есть уравнение состояния смеси идеальных газов (Менделеева-Клапейрона). С учетом закона Дальтона оно имеет вид

 – эффективная или кажущаяся молярная масса газовой смеси.
– эффективная или кажущаяся молярная масса газовой смеси.
Вне смеси любой газ при заданном давлении и температуре смеси (Pсм, T) занимал бы объем Vj, определяемый из уравнения
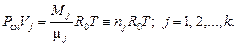 (3. 2)
(3. 2)
Эти условные для смеси объемы называют парциальными объемами. Из уравнений (3. 1), (3. 2) ввиду равенства их правых частей следует, что
|
|
|
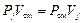 или
или 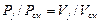 .
.
Суммируя это уравнение по j, с учетом закона Дальтона получаем
 .
.
Эффективную молярную массу смеси можно рассчитать, если известны объемные доли компонентов смеси ri=Vj/Vсм. Перепишем уравнение (3. 2) в виде
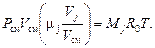
Суммируя по j левые и правые части этого уравнения, с учетом вида уравнения состояния газовой смеси находим
 .
.
Замечание 1. Выше было получено, что  . Из уравнения (3. 1) и уравнения состояния смеси следует, что
. Из уравнения (3. 1) и уравнения состояния смеси следует, что  , т. е. объемные и молярные (nj / n) доли совпадают:
, т. е. объемные и молярные (nj / n) доли совпадают:
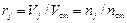 .
.
Замечание 2. Реальными величинами газовой смеси являются количества молекул каждой компоненты смеси (Nj). Общее количество молекул смеси  . Поскольку каждый киломоль любого вещества по определению содержит одно и то же число молекул (NA), то общее число киломолей в смеси равно сумме киломолей компонент смеси (nj):
. Поскольку каждый киломоль любого вещества по определению содержит одно и то же число молекул (NA), то общее число киломолей в смеси равно сумме киломолей компонент смеси (nj):
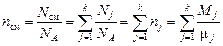 .
.
По определению μ см:
a) 
б) 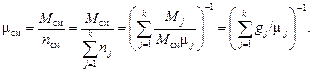
Теплоемкость смеси идеальных газов
Удельная теплоемкость вещества определяется как теплоемкость:
а) единицы его массы (кг) – массовая удельная теплоемкость, сm [Дж/(кг·K)];
б) единицы его количества (кмоль) – молярная (мольная) удельная теплоемкость, сμ [Дж/(кмоль·K)];
в) единицы его объема (м3) – объемная удельная теплоемкость, с* [Дж/(м3·K)].
Для смеси идеальных газов или любой другой ее компоненты, имеющей массу M (кг), содержащей n киломолей и занимающей объем V (м3), изменение количества тепла DQ и соответствующее изменение температуры DT связаны уравнениями (сm, сμ , с* – средние значения)
DQ= сm·M·DT= сμ ·n·DT= с*·Vн·DT.
Здесь Vн – объем, который занимает газ массой M при нормальных физических условиях: P0=101325 Па, T0=273, 15 К. Отсюда получаем соотношения:

Для смеси 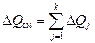 , следовательно,
, следовательно,
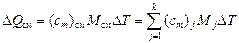 ,
,
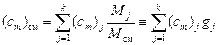 ,
,


Если смесь задана объемными долями, то

и

Здесь Vj – парциальные объемы.
|
|
|


