 |
Основы электрохимических процессов
|
|
|
|
ОСНОВЫ ЭЛЕКТРОХИМИЧЕСКИХ ПРОЦЕССОВ
Механизм возникновения электродных потенциалов, их количественное определение, процессы, которые сопровождаются возникновением электрического тока или вызваны электрическим током, изучаются особым разделом химии – электрохимией.
7. 1. Электродные потенциалы и механизм их возникновения
Возникновение электродного потенциала связано с явлениями, происходящими на границе двух фаз (металл/электролит) с участием заряженных частиц (ионов и электронов). На границе раздела металл ˗ электролит всегда образуется распределение электрического заряда в виде двойного электрического слоя (ДЭС).
При погружении металла в электролит, к поверхностным катионам металла притягиваются полярные молекулы воды (рис. 7. 1, а). Под действием электростатического взаимодействия с водой катионы металла с пластины в гидратированном состоянии переходят в раствор, в результате чего поверхность металла (из-за появления в ней избыточных электронов) заряжается отрицательно (рис. 7. 1, б). Далее к отрицательно заряженной пластине притягиваются из раствора гидратированные катионы и адсорбируются на ней (рис. 7. 1, в). В результате на границе металла с раствором образуется двойной электрический слой, т. е. между металлом и раствором возникает разность потенциалов. Разность потенциалов между металлом и раствором называется электродным потенциалом.
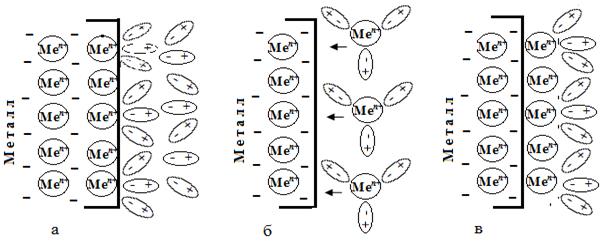
Рис. 6. 1. Схема процессов в системе металл – электролит:
а – взаимодействие поверхностных катионов металла с водой;
б – переход катионов металла в раствор и их гидратация;
в адсорбция гидратированных катионов металла
В упрощенном виде образование ДЭС показано на рис 6. 2.
|
|
|
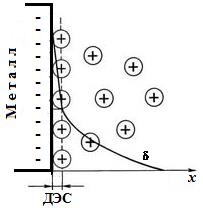
Рис. 6. 2. Образование ДЭС:
 - гидратированные катионы металла,
- гидратированные катионы металла,  - плотность заряда
- плотность заряда
Процесс, происходящий при взаимодействии металла с водой, можно записать в виде уравнения:
Ме + mH2O – n  ® Меn+(H2O)m. ® Меn+(H2O)m.
| (6. 1) |
По мере перехода катионов металла в раствор растет отрицательный заряд поверхности металла и положительный заряд раствора, что препятствует выходу катионов металла из кристаллической решетки. Поэтому наряду с выходом катионов идет обратный процесс восстановления катионов металла из раствора:
Меn+(H2O)m + n  ® Ме + mH2O. ® Ме + mH2O.
| (6. 2) |
По достижению равенства скоростей процессов (6. 1) и (6. 2) наступает равновесие, которое характеризуется определенным значением потенциала между металлом и раствором. Этот потенциал называется равновесным электродным потенциалом.
Металл, опущенный в раствор собственной соли, называется металлическим электродом. Условно металлический электрод записывается в виде Ме│ Меn+, где вертикальная черта обозначает границу между металлом и его ионами в растворе. В зависимости от активности металла и концентрации (точнее активности) его ионов в электролите возможны два механизма образования ДЭС. Характер взаимодействия полярных молекул воды с катионами металла определяется энергией кристаллической решетки металла и энергией гидратации его ионов.
Если энергия гидратации больше энергии кристаллической решетки, то катионы металла достаточно легко выходят из кристаллической решетки и в гидратированном состоянии переходят в раствор. При этом поверхность металла приобретает отрицательный заряд, а слой раствора, примыкающий к ней ˗ положительный. Такой механизм характерен для активных металлов (например, таких как Mg, Zn, Fe).
В том случае, когда металл малоактивный (например, Cu, Ag, Au), в начальный момент катионы Меn+ из раствора преимущественно адсорбируются на поверхности электрода и металлическая пластина заряжается положительно, а прилегающий к электроду раствор за счет избытка анионов отрицательно.
|
|
|
В любом случае на границе раздела двух фаз образуется двойной электрический слой. Потенциалу металла приписывается тот знак, который возникает на его поверхности в двойном электрическом слое.
Абсолютные значения электродных потенциалов экспериментально определить невозможно. Поэтому пользуются их относительными значениями, измеренными относительно некого электрода сравнения. В качестве электрода сравнения обычно используют стандартный водородный электрод.
|
|
|


