 |
Стандартный водородный электрод
|
|
|
|
Стандартный водородный электрод
Стандартный водородный электрод представляет собой платиновую пластину, покрытую тонкодисперсной платиной (платиновая чернь), погруженную в раствор серной кислоты с активностью ионов водорода 1 моль/л (рис. 7. 3). Платина играет роль проводника первого рода, через который осуществляется отвод и подвод электронов. Через раствор непрерывно под давлением 101325Па и Т=298К пропускают молекулярный водород.
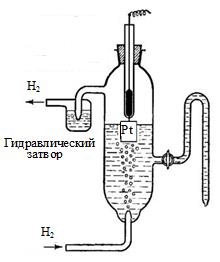
Рис. 6. 3. Стандартный водородный электрод
При контакте платины с молекулярным водородом происходит его адсорбция на платине. Адсорбированный водород под действием полярных молекул воды переходит в раствор в виде ионов, а платиновая пластина, на которой остались электроны, становится отрицательно заряженной и, в свою очередь, удерживает положительно заряженные ионы водорода. Возникает двойной электрический слой, в котором устанавливается равновесие:
2Н+ + 2  ⇄ 2Надс Û Н2.
⇄ 2Надс Û Н2.
Потенциал, при котором устанавливается равновесие, принят за ноль и называется стандартным электродным потенциалом водородного электрода (Е0Н+/1/2Н2). Условно водородный электрод записывается в виде Pt, H2│ H+.
Водородный электрод относится к газовым электродам. Кроме водородного электрода, к газовым электродам относятся электроды, у которых окисленная или восстановленная форма находится в газовом состоянии. Например, кислородный электрод Pt, О2|OH-, в котором существует следующее равновесие: О2 +Н2О +4 е ⇄ 4ОН-- Определение стандартных электродных потенциалов. Для определения стандартных электродных потенциалов металлов (Е0Меn+/Ме) собирают установку, состоящую из двух полуэлементов: металла, опущенного в раствор своей соли с активностью ионов 1 моль/л, и стандартного водородного электрода (рис. 6. 4).
|
|
|
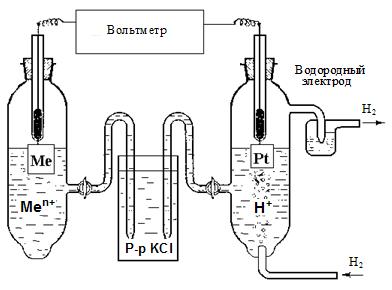
Рис. 6. 4. Установка для измерения потенциала металлических электродов
Электроды замыкают через вольтметр, а растворы электролитов – через электролитический ключ (солевой мостик). Солевой мостик представляет собой стеклянную трубку, заполненную насыщенным раствором KCl. Солевой мостик позволяет растворам обмениваться ионами, но при этом сами растворы разделены и не смешиваются.
Условная схема установки записывается в виде: Ме|Меn+||Н+|Н2, Pt, где одна черта обозначает границу между металлом и раствором, а две вертикальные черты – границу между растворами (электролитический ключ).
Если замкнуть оба электрода через вольтметр, то он покажет разность потенциалов между этими электродами:
∆ Е = Е0Меn+/Ме – Е0Н+/1/2Н2,
в которой Е0Н+/1/2Н2 =0, следовательно, ∆ Е = Е0Меn+/Ме.
Значения стандартных потенциалов металлических электродов, измеренных при Т=298К, Р=1∙ 105Па в водных растворах при активности ионов 1 моль/л сведены в таблицы.
Понятие электродного потенциала применимо не только к металлическим электродам, но и к любой системе, содержащей в растворе окисленную и восстановленную формы частиц. В такой системе протекает две окислительно-восстановительные полуреакции, сопровождающиеся переходом электронов между участвующими в реакции частицами. В общем виде этот процесс может быть записан:
Ох + n  ⇄ Red,
⇄ Red,
где Ox и Red – окисленная и восстановленная формы частиц; n – число электронов, участвующих в реакции. Например, в растворе, в которомодновременно содержатся ионы Fe2+ и Fe3+, устанавливается равновесие: Fe3+ +  ⇄ Fe2+
⇄ Fe2+
В этой системе ионы Fe3+ являются окисленной формой, а Fe2+ восстановленной формой. Для измерения электродного потенциала в таких системах, как и в случае водородного электрода, используют инертный металл (как правило, это платина): Pt|Ox, Red. Материал электрода служит переносчиком электронов. Электрод отдает окислителю или принимает электроны от восстановителя в растворе. Электроды такого типа называются окислительно-восстановительными электродами или редокс-электродами. Окислительно-восстановительный потенциал, возникающий в таких системах, не зависит от материала электрода. Значения стандартных потенциалов окислительно-восстановительных электродов, так же, как и для металлических электродов, сведены в таблицы. Следует подчеркнуть, что значение электродного потенциала относится к равновесной реакции окисления-восстановления, поэтому потенциал имеет один и тот же знак, как в процессе окисления, так и в процессе восстановления.
|
|
|
|
|
|


