 |
Влияние внешних факторов на величину
|
|
|
|
Влияние внешних факторов на величину
электродного потенциала
Электродные потенциалы металлов зависят от многих факторов: природы металла, температуры, активности и природы потенциалопределяющих частиц в растворе.
Данная взаимосвязь была установлена и называется уравнением Нернста:
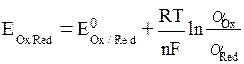 , ,
| (6. 3) |
где 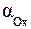 и
и  , моль/л – активности окисленной и восстановленной формы частиц; n – число электронов, участвующих в окислительно-восстановительном процессе; R = 8, 314Дж/моль∙ К – универсальная газовая постоянная; Т К – температура; F = 96500 Кл/моль – постоянная Фарадея. По физическому смыслу F – это заряд 1 моля электронов.
, моль/л – активности окисленной и восстановленной формы частиц; n – число электронов, участвующих в окислительно-восстановительном процессе; R = 8, 314Дж/моль∙ К – универсальная газовая постоянная; Т К – температура; F = 96500 Кл/моль – постоянная Фарадея. По физическому смыслу F – это заряд 1 моля электронов.
При подстановке числовых значений констант R, F и с учетом перевода натурального логарифма в десятичный, а также при Т =298 К уравнение (6. 3) имеет вид:
 , ,
| (6. 4) |
В разбавленных растворах электролитов активность с достаточным приближением можно принять равной концентрации (  С), тогда уравнение (6. 4) может быть представлено в виде:
С), тогда уравнение (6. 4) может быть представлено в виде:
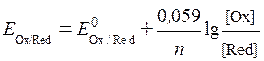 . .
| (6. 5) |
Для металлических электродов уравнение (6. 5) упрощается:
ЕМеn+/Me= Е0Меn+/Me+  . .
| (6. 6) |
Потенциал водородного электрода зависит от рН среды (с учетом того, что lg[H+]= -рН, а давление водорода РН2=1атм) и уравнение Нернста для водородного электрода имеет вид:
ЕН+/1/2Н2 = Е0Н+/1/2Н2 +  = -0, 059рН. = -0, 059рН.
| (6. 7) |
Электродный потенциал служит мерой окислительно-восстановительной способности веществ. Чем меньше значение Е0, тем большими восстановительными свойствами обладает вещество. И, наоборот, чем больше Е0, тем выше его окислительные свойства.
Электрохимический ряд напряжений металлов
Электродный потенциал металлов является мерой их восстановительной способности. Если металлы расположить по возрастанию величины их стандартных электродных потенциалов, то получим электрохимический ряд напряжений металлов, в котором чем ниже значение потенциала, тем более активным является металл, т. е. обладает большей восстановительной способностью. Таким образом, металл, имеющий более отрицательное значение потенциала, может вытеснить любой другой металл, у которого потенциал более положительный, из раствора его соли.
|
|
|
Например, цинк (Е0Zn2+/Zn = -0, 763В) может вытеснить железо (Е0 Fe2+/Fe = -0, 44В) из раствора его соли по реакции:
Zn+FeSO4=Fe + ZnSO4.
Особо следует отметить, что ряд напряжений характеризует последовательность вытеснения одних металлов другими только в водных растворах, так как характеризует потенциал восстановления гидратированного иона. Ввиду того, что ряд напряжений металлов выстроен относительно стандартного водородного электрода, металлы, стоящие до водорода, могут вытеснять его из растворовкислот. Например, никель (Е0Ni2+/Ni = - 0, 25В), при взаимодействии с серной кислотой вытесняет водород по реакции: Ni +H2SO4= NiSO4+ H2, а медь (Е0Cu2+/Cu = +0, 337В) не вступает с ней в реакцию.
Химические источники тока
Химические источники тока (ХИТ) – это устройства, в которых химическая энергия самопроизвольных окислительно-восстановительных реакций преобразуется в электрическую энергию. Химические источники тока подразделяются на первичные (не перезаряжаемые) и вторичные (перезаряжаемые). К первичным относятся гальванические элементы (ГЭ) и топливные элементы (ТЭ). Вторичными являются аккумуляторы. В аккумуляторах используемые самопроизвольные ОВР имеют высокую степень обратимости.
Причиной возникновения и протекания электрического тока в ХИТ является разность электродных потенциалов двух окислительно-восстановительных систем. Действие химических источников тока основано на пространственном разделении окислительных и восстановительных реакций, происходящих на электродах.
|
|
|
|
|
|


