 |
Кавецкий, Г.Д. Процессы и аппараты пищевой технологии / Г.Д. Кавецкий, Б.В. Васильев. – М.: Колос, 2000. – 551 с
|
|
|
|
1. Основные свойства пищевых продуктов и сырья –. Гинзбург, А. С. Теплофизические характеристики пищевых продуктов: справочник/А. С. Гинзбург, М. А. Громов. — М.: Агропромиздат, 1990. —287 с.: ил.
2. Непрерывные и периодические процессы, их характеристики и области рационального применения в биотехнологии [1, 2, 4]
Кавецкий, Г. Д. Процессы и аппараты пищевой технологии / Г. Д. Кавецкий, Б. В. Васильев. – М.: Колос, 2000. – 551 с
Космодемьянский, Ю. В. Процессы и аппараты пищевых производств / Ю. В. Космодемьянский. – М.: Колос, 1997. -208с.
Лекция №2
1. Фундаментальные законы дисциплины: законы сохранения, равновесия,
2. Фундаментальные законы дисциплины: основы теории переноса количества движения, теплоты, массы.
3. Виды переноса. Основное уравнение переноса субстанций.
Теоретическую основу ПАХТ составляют фундаментальные законы природы, к которым относятся:
1. законы сохранения субстанции (импульс, энергия, вещество);
2. законы равновесия;
3. законы переноса субстанции.
Рассмотрим каждый из этих законов более подробно.
Законы сохранения субстанции разрешают протекание только таких процессов, в ходе которых количество субстанций не меняется. Математическим выражением законов сохранения субстанции, является уравнение балансов субстанции. Поскольку перенос субстанции происходит одновременно, то подходы к составлению балансовых соотношений являются общими и заключаются в следующем:
Общее балансовое соотношение (ОБС):
Пр – Ух + Ис – Ст = Нак (Рез)
ОБС упрощается если:
– процесс стационарный (Нак = 0), Пр – Ух + Ис – Ст =0
– изолированная система (Пр = 0, Ух = 0), Ис – Ст = Нак
|
|
|
– действуют законы сохранения (Ис = 0, Ст = 0), Пр – Ух = Нак
– действуют законы сохранения и процесс стационарный Пр=Ух
Цель составления ОБС:
· проверка сходимости баланса;
· определение неизвестного параметра;
· установление зависимости между различными параметрами процесса.
Законы равновесия. Целью любого химико-технологического процесса (ХТП) является макроскопическое изменение свойств участвующих в процессе веществ. Для достижения этой цели на систему воздействуют различными внешними полями (температура, давлении и т. п), что приводит целенаправленному переносу субстанции. Большинство изучаемых в курсе процессов являются самопроизвольными, которые протекают в направлении достижения системы равновесия: такого его состояния, при котором не происходит никаких видимых изменений свойств вещества, значит перенос субстанции прекращается.
Математически условия равновесия можно сформулировать как равенство нулю полного дифференциала параметров состояния, определяющих свойства вещества, то есть
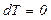 ;
; 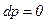 ;
;  .
.
Равенство  выражает условия термического равновесия,
выражает условия термического равновесия,  – гидромеханического равновесия,
– гидромеханического равновесия,  – химического равновесия.
– химического равновесия.
Для открытой системы (способной обмениваться с окружающей средой массой и энергией) равновесное состояние может быть устойчивым лишь при ее равновесии с окружающей средой. В противном случае состояние системы будет изменяться.
Движущая сила процессов, приводящих к изменению макроскопических свойств системы, возникает вследствие отклонения от равновесия в самой системе или в окружающей среде. Чем меньше отклонение от состояния равновесия, тем медленнее протекает процесс. При проведении технологических процессов для осуществления процессов переноса субстанций к системе подводят дополнительные неравновесные параметры: вещество или энергию.
|
|
|
Законы равновесия позволяют определить:
· условия равновесия;
· движущую силу процесса;
· направление переноса субстанции.
Законы переноса субстанции. Как известно, протекание основных процессов ХТ сопровождается переносом одной или нескольких субстанций. Законы переноса массы, энергии и импульса определяют плотность потока любой субстанции в зависимости от движущей силы процесса, т. е. интенсивность химико-технологического процесса и, в конечном счете, производительность используемых для проведения этих процессов аппаратов.
Интенсивность переноса характеризуется количеством субстанции, переносимой в единицу времени через единицу площади поперечного сечения потока – плотность потока субстанции (q).
Плотность потока субстанции или интенсивность переноса зависит от разности интенсивных величин или потенциалов переноса (φ ) – удельные (отнесенные к единице объема) масса, энергия или количество движения.
Перенос субстанции (теплоты, вещества) возможен, если в разных точках потока различны значения интенсивных свойств (t, p и т. д. ). Разница в значении интенсивных свойств (потенциалов) является причиной и движущей силой переноса экстенсивных величин.
При переносе импульса – разность давлений, при переносе тепла – разность температур, при переносе вещества – разность концентраций.
Импульса ∆ Р φ и=m*w/v = ρ *w, (кг/м2с)
Тепла ∆ Т φ т=Q/V = сptm/V = сpt ρ, (Дж/м3) удельная энтальпия
Вещества ∆ С φ в=m/V = C = ρ (кг/м3)
Перенос субстанции возможен, если в разных точках потока различны значения интенсивных параметров.
Параметры, характеризующие процесс
 |
| экстенсивные | интенсивные |
| 1. зависят от количества переносимых субстанций; 2. при сложении значения суммируются; 3. несут меру сами в себе (масса, длина, объем). | 1. не зависят от количества переносимых субстанций. 2. при сложении их значения усредняются (температура, давление); 3. нет меры, не несут меру в себе, измеряются косвенно. |
|
|
|


