 |
Химическая связь, образованная за счёт обобществления электронов связываемых атомов, называется ковалентной.
|
|
|
|
Процесс возникновения ковалентной связи происходит следующим образом. При сближении двух атомов их орбитали перекрываются, т. е. взаимно проникают одна в другую. Образуется одна общая орбиталь, охватывающая одновременно оба атома. Электроны, находившиеся ранее на орбиталях двух атомов, становятся общими. При этом в промежутке между ядрами возрастает электронная плотность, что приводит к стягиванию положительно заряженных ядер. При образовании ковалентной связи выделяется энергия, и поэтому получающаяся молекула устойчивее, чем реагирующие атомы. Этим объясняется высокая прочность ковалентной связи. Пара электронов, образующая ковалентную связь, обозначается чёрточкой.
В органических соединениях существуют два типа ковалентных связей: (сигма)- и (пи)-связи.
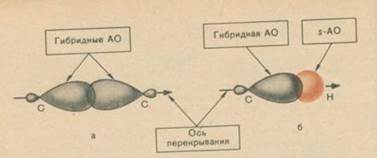
Образование -связей С – С и С – Н.
-Связь. Атом углерода образует -связь за счёт перекрывания гибридных орбиталей (sp3-, sp2- или sp-АО) с гибридными орбиталями другого атома углерода (рис. 3 а) или любыми орбиталями атомов других элементов (рис 3 б). Перекрывание осуществляется таким образом, что область максимальной электронной плотности сосредоточивается в пространстве между ядрами на прямой, соединяющей центры атомов. Такое перекрывание называется осевым.
Атомы углерода образуют -связи друг с другом и атомами других элементов, находясь в любом из трёх гибридных состояний. В sp-гибридном состоянии атом углерода способен к образованию двух, в sp2-гибридном состоянии – трёх и в sp3-гибридном состоянии – четырёх -связей. Однако, в каком бы состоянии гибридизации ни находились два взаимодействующих атома углерода, между ними может быть образована только одна -связь. Это следует из принципа Паули: на одной орбитали не может быть более двух электронов.
|
|
|
-Связь отличается большой прочностью, так как электронная плотность в ней сосредоточена на кратчайшем расстоянии между двумя ядрами. Атомы углерода, связанные -связями, образуют «каркас» органической молекулы, называемый углеродным или -скелетом. Углеродный скелет может состоять из любого числа атомов углерода, находящихся в различных состояниях гибридизации.
-Связь. Эта связь образуется при боковом перекрывании негибридизированных р-АО. При этом возникают две области максимальной электронной плотности. Атомы углерода в состоянииsp2- и sp- гибридизации имеют соответственно одну (рz) или две (py и рz) негибридизированные орбитали.
5.Гомологический ряд алканов. Номенклатура и изомерия. Радикалы алканов.
Алканами называются насыщенные углеводороды, молекулы которых состоят из атомов углерода и водорода, связанных между собой только -связями.
Алканы являются насыщенными, или предельными, углеводородами, поскольку все свободные валентности атомов углерода заняты (полностью «насыщены») атомами водорода. Простейшим представителем алканов служит метан СН4. Начиная с него, можно построить ряд, в котором каждый последующий углеводород будет отличаться от предыдущего на одну метиленовую группу СН2. Члены этого ряда называются гомологами, а сам ряд – гомологическим.
Гомологическим называется ряд соединений, имеющих однотипное строение и обладающих близкими химическими свойствами, но различающихся по числу групп СН2.
Группа СН2 называется гомологической разностью. Общая формула гомологического ряда алканов СnH2n+2 показывает соотношение между числом атомов углерода и водорода у каждого члена гомологического ряда.
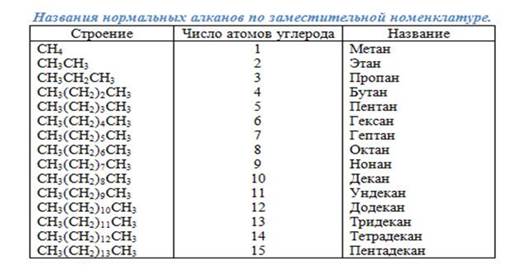
Номенклатура.
В заместительной номенклатуре ИЮПАК первым четырём членам гомологического ряда алканов утверждены их исторически сложившиеся названия – метан, этан, пропан, бутан.
|
|
|
Названия остальных алканов с нормальной, т. е. неразветвлённой, углеродной цепью, составляются из греческого или латинского названий числительного, соответствующего числу атомов углерода в цепи, с добавлением суффикса –ан. Так, греческое название числительного 5 – «пента», отсюда углеводород С5Н12 называется пентан. Для этого же соединения можно встретить название н -пентан, что подчёркивает наличие нормальной цепи.
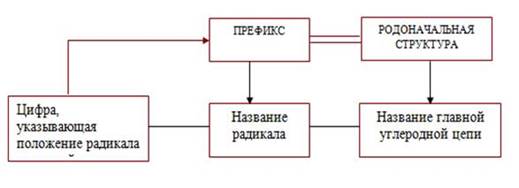
Алканы с разветвлённой цепью рассматриваются как производные нормального алкана, в котором один или несколько атомов водорода заменены на углеводородные радикалы. Названия алканов с разветвлённой цепью составляют по следующим правилам:
1) определяют родоначальную структуру, которой в случае алканов является главная углеродная цепь (самая длинная цепь атомов углерода). Число атомов углерода в этой цепи служит основой названия;
2) нумеруют главную цепь с того конца, ближе к которому находится заместитель, т. е. углеводородный радикал;
3) перед основой названия указывают номер того атома углерода в главной цепи, у которого находится заместитель, а затем в виде префикса называют этот заместитель;
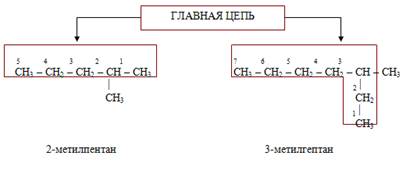
4) при наличии двух и более заместителей нумерацию цепи производят так, чтобы заместители получили наименьшие номера. В названии алкана радикалы перечисляются в алфавитном порядке. Перед названием каждого радикала ставят цифру, обозначающую его положение в главной углеродной цепи.
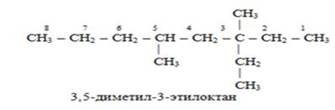
Если заместители одинаковые, то к их названию добавляют умножительные приставки ди-, три-, тетра- и т. д.
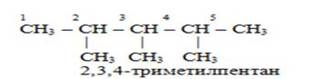
5) если в главной цепи на равном расстоянии от концов стоят одинаковые радикалы, то нумерацию производят таким образом, чтобы радикалы получили наименьшие номера.
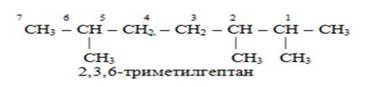
В целом построение названия алканов можно представить в виде схемы:
Структурная изомерия.
|
|
|


