 |
Получение конъюгатов гаптен-фермент, содержащих карбоксильную группу
|
|
|
|
Получение конъюгатов гаптен-фермент, содержащих карбоксильную группу
Самые распространённые методы основаны на образовании пептидной связи между аминогруппой фермента и карбоксильной группой гаптена, предварительно активированной каким-либо реагентом:
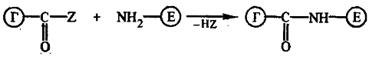
1. 1. Метод смешанных ангидридов. При взаимодействии СОО-группы гаптена с изобутилхлорформиатом в безвод. органич. р-ле при пониженной температуре легко получают смешанные ангидриды, которые без выделения реагируют с NH2-группами лизиновых остатков фермента:
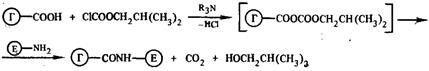 Самый распространённый.
Самый распространённый.
Минус: даже при очень высоком избытке гаптена выход сост. Лишь 20-30%.
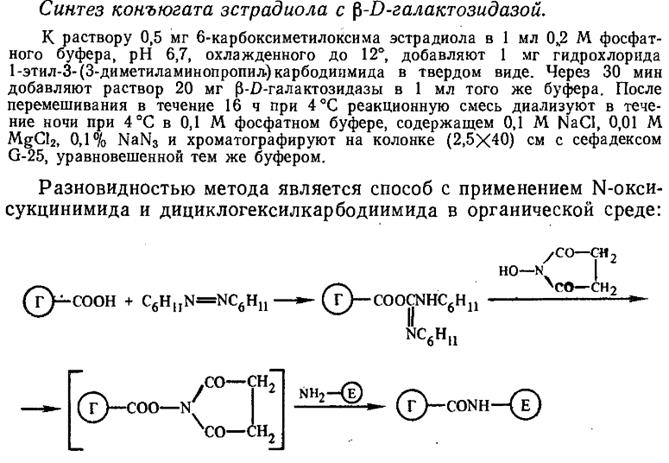
1. 2. Карбодиимидный метод. Активация СООН-групп гаптен проводят с помощью водорастворимых карбодиимидов:
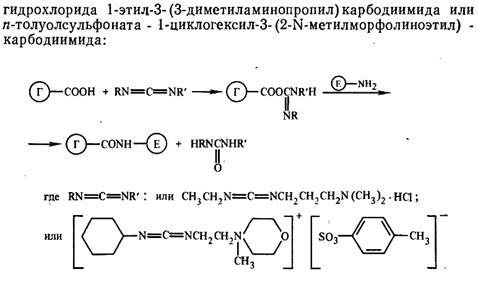 Реакцию проводят при рН 5, 5-6 в течении нескольких часов.
Реакцию проводят при рН 5, 5-6 в течении нескольких часов.
Минус: протекание внутри- и межмолекулярной сшивки фермента.
51. Физико-химические свойства ферментов, используемых в ИФА. Щелочная фосфатаза.
Ферментные маркеры, используемые в ИФА, должны обладать следующими свойствами:
– высокая активность и стабильность фермента в условиях анализа, при модификации и в конъюгате с антителами или другими белками;
– наличие чувствительных субстратов и простота метода определения продуктов или субстратов ферментативной реакции;
– возможность адаптации субстратных систем к дальнейшему усилению;
– отсутствие фермента и его ингибиторов в исследуемой биологической жидкости.
В ИФА может использоваться не менее 15 различных ферментов. Наибольшее применение, в соответствии с вышеназванными требованиями, нашли пероксидаза хрена (ПХ), щелочная фосфотаза (ЩФ) и β -D-галактозидаза. Все три стабильны и катализируют высокочувствительные реакции. Кроме того, продукты, получаемые в результате реакций, катализируемых этими ферментами, в зависимости от используемого субстрата, могут выявляться не только колориметрическими методами, но также флуоресцентными методами. Другие ферменты используются значительно реже. Это объясняется их более низкой в сравнении с ПХ и ЩФ удельной активностью.
|
|
|
Щелочная фосфатаза.
Структура. Продажными препаратами ЩФ являются фермент из кишечника телят и из Е. coli. В качестве метки в иммуноферментном анализе обычно используют первый из них, так как он обладает более высокой удельной каталитической активностью. Молекула ЩФ представляет собой димер с М~100 000. В состав каждой из субъединиц, входят два сильно связанных атома цинка, один из которых существен для поддержания структурной целостности молекулы, а второй входит в состав активного центра и принимает участие в каталитическом акте.
Специфичность. ЩФ катализирует гидролиз различных ортофосфатных эфиров, в том числе первичных и вторичных спиртов, сахарных спиртов, циклических спиртов и фенолов:
моноэфир ортофосфорной кислоты +Н20=спирт+РО43-
Ионы Mg2+ являются сильными активаторами фермента. Фосфат- ион и хелаты двухвалентных металлов, например ЭДТА, ингибируют фермент. На активность ЩФ значительное влияние оказывает электростатическое окружение (ионная сила, растворитель).
В сухом виде или в суспензии (3, 2 М раствора сульфата аммония), pH 7, содержащего 1 мМ MgCl, ЩФ стабильна в течение нескольких месяцев при 4°С Методы определения:
1) Фотометрический метод определения каталитической активности щелочной фосфатаэы с использованием 4-нитрофенилфосфата.
2) Флуориметрический метод определения ферментативной активности с использованием 4-метилумбеллиферилфосфата.
|
|
|


