 |
39. Взаимодействие одной субпопуляции антител с моновалентным антигеном. Расчет констант комплексообразования с помощью метода Скэтчарда.
|
|
|
|
39. Взаимодействие одной субпопуляции антител с моновалентным антигеном. Расчет констант комплексообразования с помощью метода Скэтчарда.
Взаимодействие одной субпопуляции анти тел с моновалентным антигеном.
Этот наиболее простой случай реализуется, например, при связывании гаптена с Fab-фрагмента-мимоноклональных антител и описывается простейшей схемой. Из системы уравнений материального баланса:
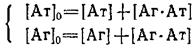
с учетом для константы равновесия комплексообразования можно легко получить выражения равновесной концентраций образовавшегося комплекса:
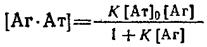
1. Один из часто используемых способов расчета константы состоит в исследовании зависимости образующегося комплекса от общей концентрации антигена о. Если при достаточно больших концентрациях антигена в системе выполняется условие, то принимает вид:
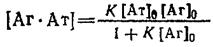
2. Иногда для вычисления константы связывания К используют представление экспериментальных данных зависимости концентрации комплекса от концентрации свободного антигена в системе двойных обратных координат:
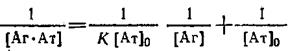
При постоянной концентрации антител в системе варьируют начальную концентрацию антигена и в условиях равновесия определяют концентрацию свободного и связанного в комплекс антигена. График в двойных обратных координатах представляет собой прямую линию с тангенсом угла наклона, отсекающую на оси ординат отрезок 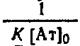
В условиях избытка антигена анализ проводят в координатах 1/0.
3. Наиболее часто для анализа комплексообразования используют метод Скэтчарда, основанный на исследовании зависимости отношения равновесной концентрации комплекса к концентрации свободного антигена от концентрации комплекса.
|
|
|
Аналитический вид уравнения Скэтчарда легко получить из выражения для константы комплексообразования и уравнения материального баланса:
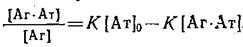
Графическая обработка экспериментальных данных в координатах Скэтчарда позволяет вычислить не только равновесную константу связывания, но и концентрацию активных центров антител 0 в системе. На практике при нахождении константы данным способом проводят серию опытов по определению равновесной концентрации свободного антигена при различных начальных концентрациях антигена и постоянной концентрации антител в системе.
40. Физико-химические свойства ферментов, используемых в ИФА. Малатдегидрогеназа.
Структура ферментов. В активном центре фермента происходит связывание субстрата и его химическое превращение. Иногда в состав таких центров входят так называемые кофакторы — низкомолекулярные органические вещества довольно сложного строения или неорганические ионы. Кофактор, прочно связанный с белковой глобулой (апоферментом) и остающийся в неизменном состоянии после каталитического акта, называют простетической группой. Если условия окружающей среды изме няются таким образом, что часть взаимодействий нарушается или отсутствует, нативная конформация молекулы существенно меняется, при этом способность фермента осуществлять каталитическое превращение субстрата падает. Такой процесс называют денатурацией. Факторами, вызывающими денатурацию, могут являться повышение температуры, изменение pH, введение химических агентов, механическое воздействие.
Каталитические свойства ферментов. Общую схему фермента тивной реакции обычно записывают следующим образом: S1 +S2---» P1 + P2 где S1 и S2 — субстраты; P1 и Р2 — продукты ферментативной ре акции; Е — фермент. Для многих ферментов в качестве одного из субстратов вы ступает вода, поэтому, ввиду того, что ее концентрация велика и постоянна в ходе ферментативной реакции, часто такие реакции рассматривают как псевдомоносубстратные. Весьма важной и часто используемой на практике характеристикой препаратов является каталитическая активность фермента. За единицу каталитической активности (1 каталь) любого фермента принимают такое его количество, которое катализирует превращение 1 моль субстрата. Для сравнительной оценки различных препаратов фермента часто используют удельную каталитическую активность, т. е. каталитическую активность, отнесенную к единице массы белка.
|
|
|
На скорость ферментативной реакции оказывают влияние различные факторы, среди которых основными являются темпе ратура, природа буфера и pH, субстраты, коферменты, ингибито ры й другие эффекторы, а также количество белка в системе.
|
|
|


