 |
45. Термодинамические закономерности реакции взаимодействия антиген-антитело.
|
|
|
|
45. Термодинамические закономерности реакции взаимодействия антиген-антитело.
Константа образования комплекса – термодинам. параметр, характеризующий изменение свободной Е при взаимодействии Ат с Аг.
Δ F0=-RTlnKa или Ka=e-Δ F/RT
Стандартное условие: изменение 1 моль Аг и 1 моль Аг-связывающих участков Ат.
Подставив конкретные величины в ур-ние изменения свободной Е, можно показать, что 10-кратное увеличение при 370С соответствует изменению свободной Е, равной 1, 42 ккал/моль (меньше Е Н-Н связей=4, 5).
Низкоаффинное взаимодействие:
↑ аффинность (1010 М-1), изменение свободной Е -14, 2 ккал/моль, что приблизительно эквивалентно Е 3-х Н-Н связей.
Незначительное изменение структуры Аг может существенно изменить аффинность.
Ка – величина постоянная при любом заданном состоянии. При варьировании параметров=> изменения образования комплекса.
Общее изменение свободной Е при образовании комплекса:
Δ F0=Δ μ 0-Δ S0T – ур-ние Вантгоффа
Можно показать, что изменени аффинности от Т 0С описывается след. выражением:
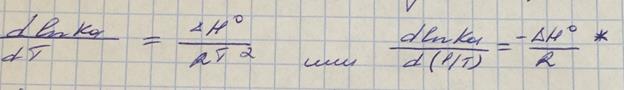 |
ln от обратной Т (1/Т) – изменение Н
tgα =*, т. е. используя данный подход можно найти термодинам. параметр.
Энтальпию можно найти (изменение) с помощью прямой колориметрии.
Сильное экзотерм. Взаимодействие: ↑ аффинности, при изменении Т, Δ Н – отрицательное большое значение.
Ат+Аг при 40С сильнее.
Неполярные взаимодействия (гидрофобные) опред. энтропийным S членом ур-ния. Изменение Н близко к 0. Аффинное мало зависит от Т.
Влияние значения рН и [солей] (ионная сила раствора) зависят от природы взаимодействующих групп.
рН=7 и при физиологических [солей] – 0, 15 моль NaCl.
↓ аффинность, если большую роль играют ионные взаимодействия.
|
|
|
46. Физико-химические свойства ферментов, используемых в ИФА. Глюкозо-6-фосфатдегидрогеназа.
Иногда в состав активных центров входят кофакторы – низкомолекулярные органические вещества довольно сложного строения или неорганические ионы. Кофактор, прочно связанный с белковой глобулой (апоферментом) и остающийся в неизменном состоянии после каталитического акта называют простетической группой(это например молекула гема, принимающая участие в катализе пероксидазой).
Иногда кофактор менее прочно удерживается в активном центре и химически изменяется в результате протекания каталитической реакции. Они называются коферменты (например АТФ).
В ИФА введение ферментной метки осуществляется путем ковалентного связывания молекулы фермента с молекулой антигена и антитела. При этом оно должно проводиться таким образом, чтобы модификация фермента не вызывала его инактивации.
Глюкозо- 6- фосфатдегидрогеназа (КФ 1. 1. 1. 49)
Фермент выделен как из тканей млекопитающих, так и из бактерий. Молекула состоит из двух субъединиц, каждая из которых содержит вблизи активного центра реакционноспособный остаток лизина. В иммуноферментном анализе часто используют бактериальную глюкозо- 6- фосфатдегидрогеназу. Фермент не содержит SH- групп и обладает высокой стабильностью более 1 года при 4°С. Фермент катализирует реакцию окисления глюкозо- 6- фосфата с образованием 6-фосфо-D-глюконата:
Глюкозо- 6- фосфата+ NADP+ = 6-фосфо-D-глюконат+ NADP+ Н+
В отличии от фермента из млекопитающих бактериальная глюкозо- 6- фосфатдегидрогеназа эффективно используют в качестве кофермента не только NADP+ но и NAD+ . Большинство двухвалентных ионов металлов являются ингибиторами фермента. Mg2+ в концентрации до 10мМ активирует, но при высоких концентрациях также ингибирует его. Ингибирующий эффект оказывает фосфат-ионы.
|
|
|
Принцип измерения каталитической активности основан на регистрации образующейся в реакции восстановленной формы кофермента (коэффициент молярного поглощения NADPH при длине волны 340 нм равен 6, 22*103 М-1 см-1).
47. Кинетические закономерности реакции взаимодействия антиген-антитело.
Образование, комплекса антиген—антитело является обратимым процессом, т. е. равновесная константа связывания (аффинности) данного комплекса определяется отношением константы скорости ассоциации к константе скорости диссоциации.
k-1 (K= k1/ k-1)
Исследование кинетики процесса комплексообразования антигенов с центрами связывания антител в широком диапазоне концентраций, включая избыточные концентрации каждого из реагентов, позволяет определить значения кинетических констант скоростей ассоциации и диссоциации, рассчитать время, необходимое для достижения системой равновесия. Реакция антиген—антитело в диапазоне таких концентраций реагентов (антигена и антител), которые регистрируются обычными физико-химическими методами(спектрофотометрическими, иефелометрическими и др. ), протекает очень быстро» что затрудняет ее изучение с помощью традиционных кинетических методов.
При высоких концентрациях реагентов лимитирующим фактором является время смешивания растворов, так как равновесие устанавливается за время, которое не позволяет определять изменения концентраций реагентов.
Для нахождения кинетических констант реакции антиген—антитело могут быть применены два экспериментальных подхода. Первый из них состоит в использовании специальных приемов для изучения быстрых реакций — метода температурного скачка (является одним из релаксационных методов, основанных на принципе зависимости времени достижения нового равновесного состояния системы, обусловленного быстрым внешним воздействием, от констант скоростей прямой и обратной реакций) и метода остановленной струи. Второе направление связано с применением реагентов, позволяющих следить за реакцией комплексообразования (этот метод, нашел большое применение в связи с развитием высокочувствительных методов иммуноанализа, основанных на использовании меченых реагентов: радиоиммунологического, иммуноферментного и других методов) в области ультранизких концентраций реагентов. Переход к низким концентрациям реагентов (< 10~9 М) дает возможность значительно понизить скорость реакции и использовать для расчетов традиционные кинетические методы.
|
|
|
Основная часть кинетических экспериментов, приведенных в литературе, выполнена, для взаимодействия гаптенов, главным образом ДНФ-лигандов. Лишь очень небольшое количество работ посвящено кинетическому исследованию взаимодействия антител с антигенами белковой природы. Это связано с тем, что кинетические данные, полученные в опытах со сложными антигенами, трудно интерпретировать.
Как для белковых антигенов, так и для гаптенов установлены достаточно высокие значения констант скоростей ассоциации, приближающиеся к диффузионно контролируемому пределу. В случае белковых антигенов их значения приблизительно на 2 порядка меньше и колеблются от 5- 10s до 5 -106 М—1 • с '1, что объясняется более сложной структурой антигенной детерминанты белковых антигенов.
Имеющиеся данные свидетельствуют о том, что наблюдаемые различия в аффинности антител обусловлены, в основном, значениями константы скорости диссоциации. Это было наглядно продемонстрировано в экспериментах с серией гомологичных гидрофобных ДНФ-лиганидов, в которых десятикратное увеличение константы аффинности для двух перекрестно реагирующих лигандов обусловлено различием в константах скоростей диссоциации, а не ассоциации. Эти и другие результаты показывают, что именно константа скорости диссоциации определяет сродство антитела к гаптену. Этот вывод, однако, нельзя считать окончательным, поскольку количество экспериментальных данных, полученных к настоящему времени, ограничено.
|
|
|


