 |
Образец билета входного тест-контроля
|
|
|
|
ОБЩАЯ ХИМИЯ
Руководство к самостоятельной работе студентов,
Обучающихся по специальности 060101 – лечебное дело,
Педиатрия, 060104 – медико-профилактическое дело
Часть 2
Уфа – 2009 г.
УДК 54(07)
ББК 24я7
О-28
Общая химия: руководство к самостоятельной работе студентов. Часть 2/ Сост.: Е.В. Пастушенко, Р.М. Бадакшанов, В.К. Гумерова, Л.Л. Костюкевич, С.Х. Нафикова – Уфа: РИО РУНМЦ МО РБ, - 2009. 120 с.
Руководство подготовлено в соответствии с типовой программой по общей химии (М., 2002 г.), на основании рабочей программы (2008 г.), действующего учебного плана (2000 г.) и в соответствии с требованиями Государственного образовательного стандарта высшего профессионального образования по специальностям 060101 – лечебное дело, 060103 – педиатрия, 060104 – медико-профилактическое дело (2000 г.).
Издание является инструкцией к усвоению и закреплению знаний студентов по общей химии в аудиторное и внеаудиторное время и содержит описание лабораторных работ, вопросы и задачи для подготовки к занятиям.
Руководство предназначено для студентов, обучающихся по специальностям 060101 – лечебное дело, 060103 – педиатрия, 060104 – медико-профилактическое дело (2000 г.).
Рекомендовано в печать по решению Координационного научно-методического совета и утверждено на заседании Редакционно-издательского совета ГОУ ВПО «Башкирский государственный медицинский университет Росздрава».
Рецензенты:
Зав. кафедрой неорганической химии Башгосуниверситета, чл.-корр. АН РБ, профессор Майстренко В.Н.
Профессор кафедры биоорганической и биологической химии Башгосмедуниверситета Галимов Ш.Н.
Ó ГОУ ВПО «Башкирский государственный
|
|
|
Медицинский университет Росздрава», 2009
ОГЛАВЛЕНИЕ
| 1. | Предисловие | ||
| 2. | Коллигативные свойства растворов | ||
| 3. | Свойства растворов электролитов. Электролитическая диссоциация | ||
| 4. | Протолитические процессы в реакциях диссоциации и гидролиза | ||
| 5. | Протолитические процессы в буферных растворах | ||
| 6. | Рубежная контрольная работа по III блоку | ||
| 7. | Гетерогенные равновесия и процессы | ||
| 8. | Комплексные соединения и лигандообменные равновесия | ||
| 9. | Электрохимические методы исследования. Потенциометрия | ||
| 10. | Рубежная контрольная работа по IV блоку | ||
| 11. | Рекомендуемая литература |
ПРЕДИСЛОВИЕ
Учебно-методическое пособие по общей химии для студентов I курса медико-профилактического, педиатрического и лечебного факультетов (часть 2) составлено с целью помочь студентам в выполнении лабораторно-практических работ и систематической подготовки к занятиям.
Студенты при подготовке к занятиям должны уяснить актуальность темы, учебные цели, умения и навыки, которые они должны получить на каждом занятии.
По предложенным вопросам и упражнениям в начале каждого занятия проверяется подготовленность студентов по данной теме. В информационной части кратко рассматриваются отдельные вопросы по занятию. Приводятся образцы решения типовых задач, по которым проверяются знания и навыки, полученные по данной теме по итогам занятия.
Дано подробное описание лабораторных и практических работ, как демонстрационных, так и индивидуального выполнения.
Имеются образцы билетов входного и выходного тестового контроля, типовые расчетные и ситуационные задачи, литература для подготовки к занятиям по каждой теме.
Заключительным итогом изучения тем каждого блока, является контрольная работа. В учебно-методическом пособии приведены теоретические вопросы и типовые задачи к контрольной работе, а также образцы билетов к контрольной работе по каждому блоку.
|
|
|
ЗАНЯТИЕ №10
Тема: Коллигативные свойства растворов.
Актуальность темы: Большинство биохимических реакций в живых организмах протекают в растворах, единственным растворителем которых является вода. Вода – прекрасный растворитель электролитов, но и многие неэлектролиты хорошо растворяются в воде. Растворы по своим физико-химическим параметрам отличаются от чистых растворителей. Коллигативные свойства растворов – это совокупность свойств, зависящих лишь от числа молекул растворенного вещества, но не зависящих от их природы. Это понижение давления насыщенного пара над раствором по сравнению с растворителем, что приводит в свою очередь к повышению температуры кипения и понижению температуры замерзания растворов, и осмотическое давление, возникающее в результате односторонней диффузии растворителя через полупроницаемые мембраны. Они подчиняются законам Ф.М. Рауля и Я. Вант-Гоффа и могут быть объяснены исходя из II закона термодинамики. Методы, основанные на измерении повышения температуры кипения и понижения температуры замерзания растворов (эбуллиометрия и криометрия), а также на измерении осмотического давления (осмометрия), находят применение при определении молярной массы растворенных веществ. Явление осмоса играет важную роль в биологических системах. Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры. Тургор клеток, обеспечивающий эластичность тканей и сохранение формы органов, обусловлен осмотическим давлением. Животные и растительные клетки имеют поверхностный слой протоплазмы, который обладает свойствами полупроницаемых мембран.
Биологические жидкости человека – кровь, лимфа, тканевые жидкости – представляют собой водные растворы низкомолекулярных (NaCl, KCl, CaCl2 и др.) и высокомолекулярных (белки, полисахариды, нуклеиновые кислоты и др.) соединений и форменных элементов – эритроцитов, лейкоцитов, тромбоцитов. Их суммарным действием определяется осмотическое давление биожидкостей. Изотоничными являются такие растворы, которые создают одинаковое осмотическое давление. При помещении клетки в такие растворы она сохраняет свой размер и нормально функционирует. Кроме изотонических растворов бывают гипер- и гипотонические растворы, в которых клетка сморщивается или лопается. Вместе с тем, гипертонические растворы находят применение в хирургии для удаления гноя, микроорганизмов и продуктов распада из ран. Ослабляющее действие глауберовой (Na2SO4∙10H2O) и горькой (MgSO4∙7H2O) солей также основано на явлении осмоса. Осмотическое давление крови у человека поддерживается на уровне740-780 кПа. Лекарственные препараты, вводимые парентерально, должны быть по возможности изотоничны биосредам. Все растворы, используемые в качестве кровезаменителей, также являются изотоничными крови.
|
|
|
Учебные цели: ознакомиться с законами Ф.М. Рауля и Я. Вант-Гоффа и на их основе научиться рассчитывать температуры кипения и замерзания растворов неэлектролитов и электролитов, осмотическое давление растворов, а также концентрации растворенных веществ и их молекулярные массы.
В результате освоения темы студент должен уметь:
· Рассчитывать повышение температуры кипения растворов;
· Рассчитывать понижение температуры замерзания растворов;
· Рассчитывать осмотическое давление;
· Рассчитывать концентрации, включая осмолярность, растворенных веществ и их молярные массы;
· Рассчитывать изотонические коэффициенты и степень диссоциации электролитов.
Для формирования умений студент должен знать:
· Закон Ф.М. Рауля и его следствия;
· Закон осмотического давления Я. Вант-Гоффа;
· Понятия: изотоничный, гипертоничный, гипотоничный растворы, изоосмия, осмолярность и осмоляльность, осмометрия, криометрия, эбуллиометрия, изотонический коэффициент;
· Взаимосвязь между повышением температуры кипения, понижением температуры замерзания, осмотическим давлением для растворов неэлектролитов и электролитов.
Вид занятия: практическое
Продолжительность занятия: 3 академических часа
|
|
|
Оснащение рабочего места: таблица Д.И. Менделеева, справочные данные по физико-химическим константам растворителей, калькулятор.
Содержание занятия
1. Контроль исходного уровня знаний (тест).
2. Разбор теоретических вопросов темы и решение типовых задач по коллигативным свойствам растворов.
3. Самостоятельная практическая работа студентов.
4. Выходной контроль знаний и умений студентов.
5. Подведение итогов занятия. Задание на дом по теме: «Свойства растворов электролитов. Электролитическая диссоциация».
Вопросы и упражнения для подготовки к занятию
1. Что понимают под термином «коллигативные свойства растворов»? Какие это свойства?
2. Что такое идеальный раствор? К каким растворам применим данный термин приближенно?
3. Какие формулировки закона Ф.М. Рауля вы знаете? Какова их математическая форма записи?
4. Какие два следствия вытекают из закона Рауля? Их формулировки и математическая форма записи? Для каких систем их можно применить?
5. Что называется температурой кипения? Температурой замерзания (плавления)? Депрессией? Повышением температуры кипения?
6. Каков физический смысл эбуллиоскопической и криоскопической констант? От каких факторов они зависят? Единицы измерения?
7. Что называют осмосом? Приведите примеры осмоса, имеющее место в природе.
8. Что такое осмотическое давление? Осмометрия?
9. Сформулируйте закон Я. Вант-Гоффа для осмотического давления. Его математическая форма записи?
10. Что называется изотоническим, гипер- и гипотоническим раствором? Что такое цитолиз (лизис) и плазмолиз?
11. В чем смысл изотонического коэффициента Вант-Гоффа? Как его можно определить экспериментально и как рассчитывают теоретически?
12. Что такое осмоляльность и осмолярность? Изоосмия? Какова ее роль в общем гомеостазе для организма человека?
13. Вычислить осмотическое давление раствора при стандартных условиях, если в 100 мл этого раствора содержится 1∙1020 молекул растворенного неэлектролита.
Ответ: 4,1 кПа.
14. При какой температуре замерзает раствор, содержащий 0,5 моль неэлектролита в 250 г воды?
Ответ: -3,72о С.
15. При растворении 13,0 г неэлектролита в 400 г диэтилового эфира температура кипения повысилась на 0,453о К. Чему равна молекулярная масса растворенного вещества?
Ответ: 145.
16. В равных количествах воды растворено в одном случае 0,5 моль сахарозы, а в другом 0,2 моль СаС12. Температуры замерзания обоих растворов одинаковы. Чему равна степень диссоциации СаС12?
Ответ: 0,75.
Литература:
[1] с.80; [3] с. 111; [4] с. 5.
Дополнительная:
1. Чанг Р. Физическая химия с приложениями к биологическим системам. –М., Мир. 1980.
|
|
|
2. Лекция по данной теме.
Образец билета входного тест-контроля
1. К коллигативным свойствам раствора относятся:
А. Осмотическое давление; Б. Понижение температуры замерзания;
В. Молярная масса; Г. Повышение точки кипения;
Д. Изменение плотности; Е. Понижение давления пара.
Ответ: А,Б,Г,Е.
2. Математическими выражениями закона Ф.М. Рауля являются:
А. Росм=RCT; Б. Pi=PoXi; В. DTз=KкрCm;
Г. X1=n1/åni; Д. (Po-P1)/Po=X2; E. I=1+a(n-1).
Ответ: Б,Д.
3. Размерность эбуллиоскопической константы:
А. оК; Б. оК л/моль; В. оК кг/моль;
Г. г/мл; Д. кПа; Е. Дж/(моль∙оК).
Ответ: В.
4. Криоскопическая константа зависит лишь от:
А. Концентрации растворенного вещества;
Б. Температуры;
B. Природы растворенного вещества;
Г. Природы растворителя;
Д. Атмосферного давления;
Е. Влажности окружающей среды.
Ответ: Г.
5. Найдите верное утверждение:
А. Раствор и растворитель кипят при одинаковой температуре;
Б. Раствор всегда замерзает при более высокой температуре, чем чистый растворитель;
В. Давление насыщенного пара над раствором меньше, чем давление насыщенного пара над чистым растворителем;
Г. Давление насыщенного пара над раствором не зависит от концентрации раствора;
Д. Закон Рауля применим к любым растворам.
Ответ: В.
6. Причиной осмоса является:
А. Наличие полупроницаемой мембраны;
Б. Градиент концентрации растворителя по разные стороны полупроницаемой мембраны;
В. Возникновение осмотического давления;
Г. Отличие давления раствора от атмосферного давления;
Д. Различие в природе растворителя и растворенного вещества.
Ответ: Б.
7. Осмотическое давление зависит от:
А. Внешнего давления среды;
Б. Концентрации растворенного вещества;
В. Температуры кипения растворителя;
Г. Природы растворенного вещества;
Д. Температуры.
Ответ: Б,Г,Д.
8. Найдите соответствия для первого раствора относительно второго:
А. Изотонический раствор 1. Р1 > Р2
Б. Гипертонический раствор 2. Р1 < Р2
В. Гипотонические раствор 3. Р1 = Р2
Ответ: А-3,Б-1,В-2.
9. Осмоляльностью называют:
А. Активную концентрацию частиц, не проникающих через идеальную полупроницаемую мембрану в единицах моляльной концентрации;
Б. Моляльную концентрацию растворенных веществ;
В. Общую концентрацию всех растворенных веществ;
Г. Число молей вещества в 1 кг растворителя;
Д. Моляльную концентрацию растворенных неэлектролитов.
Ответ: А.
10. Найдите неверное утверждение для изотонического коэффициента:
А. Это отношение осмотического давления раствора, определенное экспериментально, к теоретически рассчитанной величине осмотического давления;
Б. Это отношение практической найденной депрессии к теоретической рассчитанной ее величине;
В. Это сумма: единица плюс произведение степени диссоциации на разность числа образовавшихся ионов минус единица;
Г. Это отношение разности степени диссоциации минус единица к разности числа образовавшихся ионов минус единица;
Д. Это отношение понижения давления насыщенного пара, экспериментально измеренного, к понижению давления насыщенного пара, рассчитанного теоретически.
Ответ: Г.
Информационная часть
Коллигативными (или коллективными) называют такие свойства растворов, которые зависят от числа молекул растворенного вещества, но не зависят от размеров и молекулярной массы, т.е. от природы растворенного вещества. Сюда относятся:
а) понижение давления пара;
б) повышение точки кипения;
в) понижения точки плавления;
г) осмотическое давление.
При анализе результатов измерений давления насыщенного пара растворов нелетучих веществ Ф.М. Рауль (1848 г.) обнаружил следующую закономерность: парциальное давление насыщенного пара данного компонента над раствором равно давлению насыщенного пара этого компонента в чистом состоянии, умноженному на его молярную долю в растворе.
Pi=PoXi, где
Pi – давление насыщенного пара над раствором;
Po – давление насыщенного пара чистого растворителя;
Xi – мольная доля растворителя.
Эта зависимость называется законом Рауля. Парциальным давлением называется частичное давление, создаваемое данным компонентом. Молярная доля (или мольная доля) компонента – это отношение количества моли данного компонента, содержащегося в данной системе, к общему числу молей системы:
X1=n1/åni, где
Для двухкомпонентной системы (растворитель + одно растворенное вещество) можно показать, что Х1 + Х2 = 1. Тогда закон Рауля можно записать:
Р1=Ро(1-Х2) или (Ро-Р1)/Ро=Х2
Относительное понижение давления насыщенного пара растворителя над раствором нелетучего электролита равно мольной доле растворенного вещества. Это другая формулировка закона Рауля.
Закон Рауля строго соблюдается только для идеальных растворов или очень разбавленных растворов неэлектролитов, если растворенное вещество и растворитель имеют большую разницу в температурах кипения. Из закона Рауля вытекают 2 важных следствия:
· Повышение температуры кипения растворов;
· Понижение температуры замерзания растворов по сравнению с чистым растворителем.
Температурой кипения называют ту температуру, при которой давление насыщенного пара над жидкостью становиться равным внешнему атмосферному давлению при прочих равных условиях. Разность температур кипения раствора и растворителя называют повышением температуры кипения раствора, т.е. DТкип=Траствора-Траствориителя. Из закона Рауля вытекает:
DТкип=Еэб∙Сm, где
Еэб – коэффициент пропорциональности, называемый эбуллиоскопической константой. Физический смысл Еэб – это DТкип для одномоляльного раствора нелетучего неэлектролита;
Сm – моляльная концентрация растворенного вещества (моль/кг), рассчитываемая по формуле:
Сm=  , где
, где
а и b – массы растворенного вещества и растворителя, соответственно;
М – молярная масса растворенного вещества.
Температурой замерзания (температурой плавления) называют ту температуру, при которой давление насыщенного пара над кристаллами льда и над жидкостью равны при прочих равных условиях. Из закона Рауля вытекает, что растворы замерзают при более низкой температуре, чем чистый растворитель. Разность температур замерзания растворителя и раствора называют понижением температуры замерзания раствора или депрессией DТзам=Трастворителя-Траствора.
DТзам=Ккр∙Сm, где
Сm – моляльная концентрация растворенного вещества;
Ккр – постоянная величина, называемая криоскопической константой.
Физический смысл Ккр – это депрессия одномоляльного раствора неэлектролита. Ниже приведены эбуллиоскопические и криоскопические константы для некоторых растворителей.
| Растворитель | Еэб, оК кг/моль | Ккр, оК кг/моль |
| Вода Этанол Бензол Диэтиловый эфир Диоксан Уксусная кислота Хлороформ | 0,52 1,22 2,57 2,02 3,20 2,93 3,63 | 1,86 1,99 5,12 1,73 4,71 3,90 4,68 |
Осмосом называют явление односторонней диффузии растворителя через полупроницаемую перегородку от раствора с меньшей концентрацией растворенного вещества к раствору с большей концентрацией. Причина осмоса – градиент концентрации растворителя по разные стороны полупроницаемой мембраны.
Чтобы остановить явление осмоса надо приложить некоторое внешнее давление к раствору.
Осмотическим давлением называют то внешнее давление, которое нужно приложить к раствору в процессе осмоса, чтобы осмос прекратился. Осмотическое давление не зависит от природы мембран и вещества, а зависит от концентрации раствора и температуры. Явление осмоса играет огромную роль для жизнедеятельности животных и растительных организмов. Процессы поступления в клетки питательных и лекарственных веществ, а также вывод из клеток продуктов обмена связаны с осмосом. Действия многих лекарственных веществ связано с повышением или понижением осмотического давления.
Анализируя результаты изучения осмотического давления разных растворов, Я. Вант-Гофф (1887 г.) пришел к выводу, что осмотическое давление пропорционально молярной концентрации растворенного неэлектролита и температуре:
Росм=RCT, где
R = 8,31 Дж/моль∙Ко;
С – молярная концентрация, моль/л;
Т – температура по шкале Кельвина.
Это выражение называют законом Фант-Гоффа для осмотического давления.
Осмометрией называют методы, основанные на измерении осмотического давления раствора. Приборы для этих целей называют осмометрами. Чаще для измерения осмотического давления используют косвенные методы – криометрию (измерение депрессии) и эбуллиометрию (измерение повышения температуры кипения), а также метод плазмолиза (сморщивания клеток при их помещении в гипертонический раствор). Это показывает количественную взаимосвязь коллигативных свойств разбавленных растворов неэлектролитов.
Широко применяемый в медицине термин «изотонический раствор» (0,9% раствор NaCl в воде) имеет такой физико-химический смысл: раствор, имеющий одинаковое осмотическое давление с сывороткой крови. Раствор с большим осмотическим давлением, чем осмотическое давление сыворотки крови называют гипертоническим, с меньшим – гипотоническим. Такое деление растворов относительно, оно имеет смысл только при сравнении одного раствора с другим. Если два раствора имеют одинаковые значения осмотического давления, они называются изотоническими по отношению друг к другу. Осмотическое давление крови человека при 37о С имеет значение 780 кПа (7,7 атм.). При помещении клеток в изотонический раствор они сохраняют свой размер и нормально функционируют. Если же помещать клетки в гипертонический раствор, то они сморщиваются из-за того, что вода уходит из клеток. Это явление плазмолиза. И, наоборот, при помещении клеток в гипотонический раствор вода переходит из раствора в клетку, она набухает и лопается с разрывом оболочки. Это явление лизиса (в случае эритроцитов – гемолиза).
В качестве кровезаменителей используется только изотонические растворы, содержащие те же компоненты и в том же количестве, что и входящие в состав крови.
Строго говоря, законы Рауля и Вант-Гоффа применимы для идеальных растворов, т.е. для растворов, в которых отсутствуют взаимодействия между молекулами и образование которых не сопровождается тепловыми явлениями. Реальные растворы (кроме очень разбавленных растворов неэлектролитов) не подчиняются законам идеальных растворов. Это особенно заметно для растворов электролитов. Чтобы использовать законы идеальных растворов для количественного описания коллигативных свойств электролитов, Я. Вант-Гофф ввел в соответствующие уравнения поправочный коэффициент i, называемый изотоническим коэффициентов Вант-Гоффа. С учетом этого коэффициента предыдущие уравнения имеют вид:
· Для относительного понижения давления насыщенного пара:

· Для повышения температуры кипения раствора:

· Для депрессии:

· Для осмотического давления:

Изотонический коэффициент для каждого раствора может быть определен экспериментально. Например, по повышению температуры кипения, понижению давления пара или температуры замерзания, по осмотическому давлению:
 , где
, где
 ,
,  ,
,  ,
, 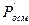 - экспериментально определенные повышение температуры кипения, понижение температуры замерзания, понижение давления пара и осмотическое давление;
- экспериментально определенные повышение температуры кипения, понижение температуры замерзания, понижение давления пара и осмотическое давление;
 ,
,  ,
,  ,
,  - те же величины, но теоретически рассчитанные для растворов неэлектролитов.
- те же величины, но теоретически рассчитанные для растворов неэлектролитов.
Изотонический коэффициент может быть теоретически рассчитан по формуле:
i=1+a(n-1), где
a - степень диссоциации электролита, т.е. a= 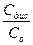 (отношение концентраций диссоциированной части электролита к общей его концентрации);
(отношение концентраций диссоциированной части электролита к общей его концентрации);
n – число ионов, которые образуются при диссоциации одной молекулы электролита.
Очевидно, i³1. Если a=0 (для неэлектролитов), то i=1. Если a>0 (для электролитов), то i>1.
Осмотическое давление биожидкостей обусловлено в основном находящимися в них электролитами. Концентрация кинетически независимых частиц в растворах электролитов всегда больше концентрации растворенного вещества вследствие их диссоциации или ионизации. В растворах, в которых содержится смесь электролитов, а к таким растворам относятся все биожидкости, расчет числа кинетически самостоятельных частиц весьма затруднен. В связи с этим в медицине широко применяются такие понятия как осмоляльность и осмолярность.
Под осмолярностью (и осмоляльностью) понимают активную концентрацию частиц, не проникающих через идеальную полупроницаемую мембрану.
Единицы измерения осмолярности совпадают с единицами измерения молярной концентрации, а осмоляльности – моляльной концентрации. Для разбавленных растворов можно принять, что численные значения осмоляльности и осмолярности совпадают. Применяется также единица измерения осмоль (осмотический моль).
Фактически осмолярность и осмоляльность, определяемые математически как «i – С» и «i – Сm» соответственно, являются эмпирическими величинами, использование которых позволяет учесть возникающие разные по характеру отклонения от законов Рауля и Вант-Гоффа в случае неидеальных растворов. Это, во-первых, увеличение числа частиц, возникающих при ионизации; во-вторых, уменьшение числа молей свободного растворителя за счет сольватации ионов; и, в-третьих, межионные взаимодействия, снижающие активность растворенных частиц.
Между клеткой и раствором, в котором она находится, возможно осмотическое передвижение воды в разных направлениях. Когда внутриклеточное содержимое будет гипотоничным по отношению к контактирующему раствору, будет наблюдаться выход молекул из клетки через плазматическую мембрану, называемый эндосмос, или плазмолиз. Плазмолиз – обратимый процесс, плазмолизированные клетки, помещенные в чистую воду, вновь набухают, восстанавливая свою жизнедеятельность. Такой процесс называют деплазмолизом.
Экзосмос наблюдается в том случае, если клетка помещается в гипотонический раствор. Процесс сопровождается увеличением объема клетки и завершается разрывом ее оболочки – цитолизом (частный случай – гемолиз).
Животные клетки, в отличие от растительных, не имеют клеточной стенки, а плазматические мембраны у них более нежны и чувствительны к изменению осмотического давления. Большинство животных способно произвольно изменять количество потребляемой воды в зависимости от потребности. Это обстоятельство привело к возникновению особой системы осморегуляции, позволяющей поддерживать общий гомеостаз. Животные, способные к регуляции осмолярности своей внутренней среды, называемой гомойосмотическими (в противоположность пойкилосмотическим). Постоянство осмолярности у животных организмов называют изоосмией. У млекопитающих, в т.ч. у человека, основным органом осморегуляции являются почки. Процесс образования мочи связан с постоянно имеющейся и постоянно изменяющейся разностью осмолярности между фильтратом, поступающим в нефрон, и тканевой жидкостью мозгового и коркового вещества почки. Проницаемость мембран для воды регулируется гормонально, что позволяет при снижении потребления воды выделять небольшие объемы концентрированной мочи, а при увеличении потребления воды – большие объемы разведенной мочи.
С помощью лекарственных препаратов можно изменить локально осмотическое давление. Это используется для усиления мочевыделения при острых отравлениях, при острой почечной недостаточности, при различных отеках. К числу осмотических диуретиков относятся манит, мочевина, ацетат калия и др.
Разбор типовых задач
1. Вычислите температуру замерзания водного раствора рибозы с массовой долей 2%
Решение. Рибоза – неэлектролит, поэтому согласно уравнению DТзам=Ккр∙Сm, где Ккр(Н2О)=1,86 Ккг/моль, найдем моляльную концентрацию 2% раствора рибозы
Сm= 
Для 2%-ного раствора а=2, b=98, М(С5Н10О5)=150 г/моль.
Тогда Сm=0,136 моль/кг.
Депрессия будет DТзам=1,86 Ккг/моль × 0,136 моль/кг = 0,253о К.
Откуда Тзамерзания раствора=Тзамерзания воды - DТзам=0о С – 0,253о С = -0,253о С
Ответ: Тзамерзания раствора = -0,253о С
2. В качестве плазмозамещающего раствора применяется раствор Рингера-Локка, имеющий пропись:
· Натрия хлорид 0,9 г
· Калия хлорид 0,02 г
· Кальция хлорид 0,02 г
· Натрия гидрокарбонат 0,02 г
· Глюкоза 0,1 г
· Вода для инъекций до 100 мл.
Вычислите осмотическое давление, создаваемое этим раствором при 25о С.
Решение: Считая, что осмотическое давление этого раствора аддитивно складывается из осмотических давлений создаваемых каждый компонентом раствора, имеем:
Росм=Р1+Р2+Р3+Р4+Р5
Для глюкозы осмотическое давление рассчитывается по формуле:
Р=R×C×T
Для электролитов – по формуле:
Р=i×R×C×T
Найдем молярные концентрации компонентов раствора:
С  =
= 
С  =
= 
С  =
= 
С  =
= 
С  =
= 
Т= 273о + 25о С = 298о К
R = 8,31 Дж/моль×К.
В первом приближении учтем, что a=1, т.е., все молекулы электролитов полностью диссоциированы и ионы не взаимодействуют друг с другом. Тогда из соотношения i = 1 + a(n – 1) для NaCl, KCl и NaHCO3 имеем i=2, для СаС12: i = 1 + 1(3 - 1) = 3.
Подставляем это значение в первое уравнение:
Росм = Р  + Р
+ Р  + Р
+ Р  + Р
+ Р  + Р
+ Р  =
=
= 2×8,31×0,154×298 + 2×8,31×0,00268×298 + 3×8,31×0,00180×298 +
+ 2×8,31×0,00238×298 + 8,31×0,00556×298 =
= 8,31×298×(0,308 + 0,00536 + 0,00540 + 0,00476 + 0,00556) =
= 2476,38×0,32908 = 814,93 кПа
Ответ: 814,93 кПа.
3. Водный раствор магния хлорида с концентрацией 0,1 моль/л имеет при 298о К осмотическое давление 691 кПа. Вычислите изотонический коэффициент магния хлорида и степень его диссоциации в этом растворе.
Решение: Согласно уравнению закона Вант-Гоффа для электролитов имеем
Росм=i×R×C×T,
откуда

Учитывая, что
 ,
,
где для MgCl2 n=3, найдем a.

Ответ: i=2,79; a=0,895.
4. Вычислите молярную массу неэлектролита, если известно, что температура кипения раствора, содержащего 1 г этого вещества в 20 г диоксана, равна 101,9о С, а температура кипения чистого диоксана равна 100,8о С.
Решение: Для неэлектролита согласно следствию из закона Рауля имеем:
DТкип=Еэб∙Сm,
где Еэб для диоксана равна 3,2
DТкип = Траствора – Тдиоксана = 101,9 – 100,8 = 1,1о К,
тогда

Согласно соотношению

имеем:

Ответ: Мнеэлектролита = 145,5 
Практическая работа
Ответьте на поставленные вопросы и решите следующие задачи исходя из законов Рауля и Вант-Гоффа:
1) Разбавленные растворы сахарозы и глюкозы имеют равные массовые доли воды. Какой из этих растворов будет кипеть при более высокой температуре? Ответ обосновать.
2) Как будет меняться во времени осмотическое давление раствора, в котором происходит ферментативный гидролиз дипептида? Ответ обосновать.
3) Водные растворы мочевины и сахарозы разделены полупроницаемой мембраной. Направленного переноса растворителя через мембрану не происходит. Какой их растворов имеет большее значение массовой доли растворенного вещества? Ответ обосновать.
4) Объясните, почему водный раствор мочевины кипит при температуре выше 100о С, а водный раствор этанола – при температуре ниже 100о С при равных массовых долях растворенных веществ?
5) Молярная концентрация мочевины в ее бензольном растворе равна молярной концентрации мочевины в ее водном растворе. Какой раствор – водный или бензольный – имеет большее значение величины депрессии? Ответ обосновать.
6) Выведите молекулярную формулу эритрозы, имеющей состав Сn(Н2О)n, если известно, что водный раствор, содержащий 10 г эритрозы в 1 кг воды, замерзает при -0,155о С.
7) Опишите поведение эритроцитов при 310о К в растворе мочевины с молярной концентрацией 0,3 моль/л.
8) У человека осмолярность интерстициальной жидкости повышается с 0,3 осмоль/л в корковом веществе до 1,2 осмоль/л в сосочке нефрона. Вычислите, как изменяется при этом осмотическое давление.
9) Плазме крови изотоничен раствор хлорида натрия с массовой долей 0,9%. Плотность этого раствора равна 1,005 г/мл. Вычислите изотонический коэффициент и степень диссоциации хлорида натрия в таком растворе.
10) Рассчитайте осмотическое давление, которое создает «Квартасоль» (плазмозамещающий раствор), при температуре 37о С, если принять степени диссоциации солей 0,8; 0,85; 0,75 и 0,9 в порядка их перечисления. Состав «Квартасоль»:
Натрия хлорид 0,475 г
Калия хлорид 0,15 г
Натрия ацетат 0,26 г
Натрия гидрокарбонат 0,1
Вода для инъекций до 100 мл
|
|
|


