 |
Вычисление рн при титровании
|
|
|
|
В процессе кислотно-основного титрования в водных растворах изменяется концентрация ионов водорода или водородный показатель рН раствора.
рH = -lg 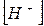
Вычисление рН раствора в различные моменты титрования необходимо для выбора индикатора и для определения ошибок титрования из-за несовпадения момента изменения окраски индикатора с точкой эквивалентности.
При титровании сильной кислоты сильным основанием (щелочью) реакция сводится к взаимодействию
Н+ + ОН- = Н2О
До начала титрования концентрация ионов водорода равна концентрации кислоты, т.е. [ Н+] = Ск
рН = - lg Cк
До точки эквивалентности концентрация ионов водорода равна концентрации оставшейся в растворе кислоты, которую вычисляют по формуле
[H+] = Ск (1 - f) (2.23.)
С учетом изменения объема раствора в процессе титрования
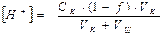 (2.24)
(2.24)
где [H+] - молярная концентрация ионов водорода в растворе оставшейся кислоте, моль/л;
СК - концентрация кислоты, моль/л;
f – cтепень оттитрованности, вычисляемая по формуле
f = CЩ · VЩ / CК VК (2.25.)
где Vщ – объем раствора щелочи, добавленного к кислоте в данный момент титрования, мл;
VК - исходный объем раствора кислоты, мл.
СЩ - концентрация щелочи, моль/л
При равных концентрациях кислоты (СК) и щелочи (Сщ) степень оттитрованности рассчитывают по формуле
f = VЩ /VR = Vщ / VТЭ (2.26.)
pН = - lg[H+]
В точке эквивалентности количество молей эквивалентов кислоты (nЭК) и щелочи (nЩ) равны, поэтому
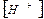 =
= 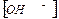 = 10-7 моль/ л
= 10-7 моль/ л
и рН раствора определяется только константой реакции титрования и равна
рН = - 1/2 pKW = - 1/2 · lg 10-14 = 7 (2.27.)
где рКW - ионное произведение воды.
После точки эквивалентности nк < nщ , в растворе избыток щелочи, концентрация ионов водорода вычисляется по формуле
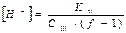 (2.28)
(2.28)
Сщ - нормальность щелочи, моль экв./л.
|
|
|
или с учетом изменеия объема в процессе титрования
 (2.29)
(2.29)
. Пример 2.6. Вычислите рН раствора, если к 50,00 мл 0,1М раствора соляной кислоты добавлено: а) 25,00 мл, б) 52,08 мл,
в)53 мл 0,096 М раствора гидроксида калия.
Решение.
а) Степень оттитрованности f = CЩ VЩ/ CК VК = 0,096 25 / 0,1 50 = 0,48 ‹ 1, следовательно, концентрацию ионов водорода рассчитываем по формуле (2.26.) до ТЭ:
[H+ ] = 0,1 (1 - 0,48) 50 / (50 + 25) = 0.035 моль/л
[H+] = (0,1 · 50 – 0,095 · 25) / 75 = 0,035 моль/л
pH = - lg [H+] = - lg 0,035 = 1,56
б) Степень оттитрованности f = 0,096 52,08/ (0,1 50) = 1,0 - ТЭ
Концентрация ионов водорода 10-7 моль/л
рН = 7.
в) Степень оттитрованности f = 0,096 · 53 / 0,1 50 = 1,02 > 1 - после ТЭ
Концентрация ионов водорода по формуле (2.29.) равна
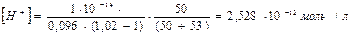
Водородный показатель равен
pН = - lg [H+] = - lg 2,528 · 10-12 = 11,6
При титровании слабой кислоты НА сильным основание м по реакции
НА + ОН- = А- + Н2О
Константа равновесия ее равна
К = [A-]/[HA] · [OH-] = K(HA) / KW
где К(НА) - константа диссоциации кислоты.
В начале титрования концентрации ионов водорода в растворе слабой кислоты вычисляется по формуле
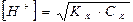 (2.30)
(2.30)
где КК - константа диссоциации кислоты 

При добавлении щелочи в растворе образуется буферная смесь из неоттитрованной кислоты и ее соли.
До точки эквивалентности (буферный раствор) концентрацию ионов водорода вчисляют по формуле
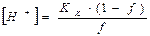 (2.31)
(2.31)
где f - степень оттитрованности вычисляют по формулам (2.24 или 2.25)
С учетом разбавления
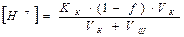 (2.32)
(2.32)
В точке эквивалентности рН раствора определяется концентрацией гидроксид-ионов, полученных при гидролизе соли по аниону А-
А- + Н2О = НА + ОН-
Концентрация гидроксид-ионов с учетом разбавления равна
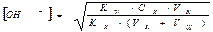 (2.33.)
(2.33.)
Без учета изменения объема раствора при титровании
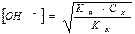 (2.34)
(2.34)
[При СК = СЩ
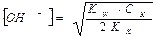 (2.35)
(2.35)
[H+] = KW / [OH-]
После точки эквивалентности рН раствора определяется избытком введенного сильного основания и концентрацию ионов водорода вычисляют по формуле (2.28.) или (2.29.).
Пример 2.7.. К 100 мл 0,1 М уксусной кислоты (К = 1,75 · 10-5) добавлено: а) 99,50 мл, б) 100,00 мл, и в) 100,50 мл 0,1 М раствора гидроксида натрия. Вычислите рН раствора в каждом случае.
|
|
|
Решение. Для реакции
СН3СООН + ОН- = СН3СОО- + Н2О
а) Степень оттитрованности по формуле (2.25)
f = 99,5 /100 = 0,995 < 1 - до ТЭ
Концентрация ионов водорода по формуле (2,32) равна

pН = - lg 4,41 · 10-8 = 7,36.
б) Cтепень оттитрованности по формуле (2,25)
f = 100 / 100 = 1 - ТЭ
Добавлено эквивалентное количество щелочи. Концентрация гидроксид-ионов по формуле (2.33) с учетом разбавления по равна
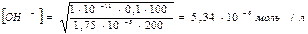

рН в точке эквивалентности
pН = - lg1,87 ·109 = 8,72
в) Степень оттитрованости f = 100,5/100 =1,005 >1, после ТЭ
Введен избыток сильного основания, концентрация ионов водородка по формуле (2.29) равна
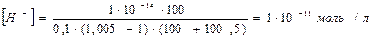
рН раствора равен
рН = – lg 1 · 10-11 = 11,0.
До точки эквивалентности f < 1 при добавлении кислоты образуется буферная смесь из слабого основания и его соли.
Концентрация ионов водорода определяют по формуле
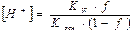 (2.37)
(2.37)
рН = - lg [H+]
где КW = 1 · 10-14 - ионное произведение воды
КОСН - константа диссоциации основания ВОН;
СОСН – молярная концентрация основания, моль/л;
f - степень оттитрованности, вычисляемая по формуле (2/19)
f = CK · VK / Cосн · Vосн (2.38)
В точке эквивалентности f = 1 концентрацию ионов водорода вычисляют с учетом гидролиза полученной соли по формуле
 (2.39)
(2.39)
Концентрация катионов соли [Ме+] равна колличеству добавленного основания

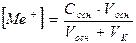 (2.40)
(2.40)
pН = - lg [H+]
После точки эквивалентности концентрация ионов водорода равна избытку добавленной кислоты с учетом разбавления и вычисляется по формуле

 (2.41)
(2.41)
где VK(ТЭ) - объем кислоты, добавленный в момент эквивалентности вычисляют по формуле
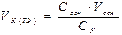 (2.42)
(2.42)
Пример 2.8. К 20,55 мл 0,1 М раствора аммиака добавлено:
а) 20,50 мл, б) 20,86 мл, в) 21,00 мл о,0985 М раствора соляной кислоты. Вычислите рН растворов в каждом случае.
Решение. Для реакции NH4OH + HCl = NH4Cl + H2O
 а) Степень оттированности по формуле (2.38) равна
а) Степень оттированности по формуле (2.38) равна
f = 0,0985 · 20,50 / 0,1 · 20,55 = 0,98 < 1 - до ТЭ
Концентрация ионов водорода по формуле (2.37)
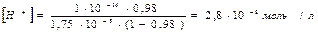
pH = -lg 2,8·10-8 = 7,55
б) Степень оттитрованности f = 0,0985· 20,86 / 0,1 · 20,55 = 1 - ТЭ
Концентрация ионов водорода по формуле (2.39) равна

По формуле (2.40.) концентрация катионов соли равна

рН = - lg 5,35 · 10-6 = 5,27
в) Степень оттитрованности
f = 0,0985 · 21 / 0,1- 20,55 = 1,007 > 1 - после ТЭ
Объем кислоты, добавленный в момент эквивалентности по формуле (2.42)
|
|
|

Концентрация ионов водорода по формуле (2.41) равна 
рН = - lg 3,46 · 10-4 = 3,46
|
|
|


