 |
Электрогравиметрический метод анализа.
|
|
|
|
Метод электрогравиметрического анализа основан на точном измерении массы определяемого вещества или его составных частей, выделяемых в химически чистом состоянии или в виде осадка, на погруженных в анализируемый раствор электродах при прохождении через раствор постоянного электрического тока. На электродах могут выделяться металлы (например, Cu) или образовываться оксиды (например, PbO2).
Образовавшийся при электролизе металл (оксид) взвешивают, и по массе выделившегося осадка определяют содержание вещества в анализируемом растворе.
Зависимость, существующая между количеством вещества, выделившегося при электролизе, и количеством прошедшего через данный раствор электричества, определяется первым законом Фарадея, согласно которому масса вещества, выделившегося на электроде, пропорциональна количеству прошедшего через раствор электричества.
Согласно второму закону Фарадея, количество вещества выделяюще-гося в разных электролитах при пропускании через раствор одинакового количества электричества, пропорциональна их эквивалентам.(Мэкв). Эти законы выражаются формулой
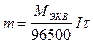 ,
,
где m - масса вещества, выделившегося при электролизе, г;
I - cила тока, А;
 - время электролиза,с;
- время электролиза,с;
I*t = Q - количество электричества, кл.
96500- постоянная Фарадея (F), т.е. количество электричества, которое требуется для выделения 1 моль - эквивалента вещества;
МЭК =М / n,
n - количество, присоединенных или отданных электронов,
М - молярная масса металла,
МЭК - молярная масса эквивалента вещества, г.
Важной характеристикой процесса является выход по току, равный отношению количества выделившегося вещества к тому количеству вещества, которое должно было выделиться по закону Фарадея. С учетом выхода по току количество выделенного вещества будет равно:
|
|
|
 ,
,
где h - выход по току %;
ή =m(прак.) / m(теор.) · 100
m(прак.) - масса выделившегося вещества, г;
m (теор.) - масса вещества, которая должна была бы выделиться по закону Фарадея, г.
Для газов, объем выделившегося газа находят из соотношения

V экв.(Н2) = 11,2 л; V экв(О2) = 5,6 л;
V экв.(С12) = 11,2 л.
Количество вещества, которое выделяется при прохождении через электролит единицы количества электричества - (Q = I*t кл) называется электрохимическим эквивалентом (Мэк / F).
Так электрохимический эквивалент серебра в реакции

равняется. МЭk(Ag) / F = 108 / 96500 = 0,001119 г/ Кл
Когда на электродах выделяется 1 моль эквивалента вещества А, то
M(A) = МЭК и  . Следовательно, величина F (число Фарадея) представляет собой заряд, переносимый 1 моль - эквивалентом какого- либо вещества А. Другими словами, прохождение через электролит 1 фарадея электричества сопровождается выделением на электродах 1 моль - эквивалентов определяемого вещества.
. Следовательно, величина F (число Фарадея) представляет собой заряд, переносимый 1 моль - эквивалентом какого- либо вещества А. Другими словами, прохождение через электролит 1 фарадея электричества сопровождается выделением на электродах 1 моль - эквивалентов определяемого вещества.
При пропускании через раствор постоянного электрического тока катионы электролита под влиянием электронов источника тока восстанавливаются на катоде в ионы низшей валентности, нейтральные атомы или атомные группы. Продукты восстановления отлагаются на катоде, вступают в реакции с молекулами растворенных веществ или растворителя, или, наконец, реагируют с материалом электрода. В это же время анионы окисляются на аноде.
Поэтому основные химические процессы, протекающие при электролизе, можно рассматривать как реакции окисления- восстановления.
Процессы восстановления, протекающие на катоде называются катодным восстановлением; процессы окисления, протекающие на аноде называют анодным окислением.
В таблицах (3.1 и 3.2) представлены катодные и анодные процессы, протекающие при электролизе водных растворов с нерастворимым анодом.
|
|
|
Таблица 3.1
Катодные процессы при электролизе растворов.
| Положение металла в ряду напряжений. |

|

|

|
| Электродная реакция на катоде. | 
|  
| 
|
Таблица 3.2
Анодные процессы при электролизе с нерастворимым анодом.
| Электродная реакция на аноде. | Е, В |
| Щелочь 4ОН- - 4е- = О2 + 2 НОН 2 I- - 2e- = I2 2 Br- - 2e- = Br2 2 C1- - 2e- = C12 2 HOH - 4e- = O2 + 4 H+ 2SO42- - 2e- = S2 O82- 2 F- - 2e- = F2 | 0.4 0.54 1.07 1.36 1.23__________________________ 2.01 эти анионы никогда не окисляются 2.87 в водных растворах солей. |
Применительно к целям электрогравиметрического анализа процесс электролиза водного раствора CuSO4 можно изобразить следующей схемой:


Образование на аноде газообразного кислорода объясняется тем, что OH-- - ионы, (образующиеся при диссоциации воды  ) окисляются легче SO42- ионов.
) окисляются легче SO42- ионов.
В тех случаях, когда Н+ - ионы восстанавливаются легче других катионов, на катоде выделяется газообразный водород. Например, при электролизе Na2SO4 на катоде вместо металлического натрия выделяется газообразный водород.
При надлежащих условиях электролиза анодное окисление Pb2+ сопровождается переходом его в Pb4+.
Например, электролиз водного сульфатного раствора, содержащего ионы свинца и меди сопровождается:
На катоде выделением меди К (-) Си2+ + 2е- = Си0
На аноде образованием PbO2 А (+) Pb2+ - 2e- = Pb4+
Pb4+ + 2 H2O = PbO2 + 4 H+,
a в растворе накапливается серная кислота
 .
.
Существует два варианта электрогравиметрического метода. По первому из них, наиболее широко распространенному, выделение вещества на электродах происходит при действии постоянного тока, полученного от внешнего источника питания. По второму варианту постоянный ток возникает при погружении в анализируемый раствор так называемой гальванической пары и в этом случае внешнего источника тока не требуется. Этот вариант электрогравиметрического анализа называют методом внутреннего электролиза.
Гальваническая пара представляет собой два, соединенных металлическим проводником электрода, отличающихся значениями нормальных электродных потенциалов. Чем больше разность электродных потенциалов металлов, образующих гальваническую пару, тем больше Э.Д.С. этой пары.
Электролиз данного электролита начинается при определенном напряжении, называемом потенциалом разложения. Для того, чтобы электролиз проходил быстро, напряжение тока в цепи поддерживают выше потенциала разложения. При этом часть электроэнергии превращается в тепло. Избыточное напряжение, которое необходимо создать на данном электроде, чтобы нормально протекал электролиз, называют перенапряжением. Перенапряжение обеспечивается протеканием на поверхности электродов и в непосредственной близости к ним сложных физико-химических процессов. Если исследуемый раствор содержит несколько компонентов, отличающихся различными потенциалами разложения, то можно выделить их из смеси в определенной последовательности, строго регулируя напряжение. При этом в первую очередь выделяют те металлы, которые имеют меньший потенциал разложения.
|
|
|
Для количественного выделения какого-либо катиона в виде металла или оксида металла электролиз следует проводить при строго определенных условиях.
Электролиз проводят при определенном напряжении. Следует, однако, иметь в виду, что количество выделяющегося при электролизе вещества остается неизменным независимо от источника постоянного тока, от температуры, от плотности тока, от формы электродов.
На практике потенциал электрода, на котором проводят осаждение определяемого вещества, может быть изменен в некоторых пределах. Иногда электролиз проводят при контролируемой плотности тока.
Электролиз сильно ускоряется при перемешивании и подогревании раствора. Перемешивание раствора можно проводить, пропуская через него воздух или азот, а также с помощью мешалок различных конструкций.
При электрогравиметрических определениях обычно применяют платиновые электроды, для увеличения скорости выполнения анализа им придают возможно более развитую поверхность. В большинстве случаев электроды изготавливают в виде сетчатых цилиндров, вставленных один в другой. Иногда применяют сетчатый катод и свернутый в спираль анод.
В электрогравиметрических методах анализа кроме потенциала и силы тока важно контролировать ещё ряд экспериментальных условий.
|
|
|
Осадок, выделенный электролитически для целей гравиметрического анализа, должен прочно прилипать к электроду, быть плотным и гладким, чтобы при промывании и взвешивании не происходило механических потерь или взаимодействия с окружающей средой. Хорошие металлические осадки являются мелкозернистыми и имеют металлический блеск; губчатые, порошкообразные или чешуйчатые осадки менее чистые и хуже пристают к электроду.
К основным факторам, влияющим на физические характеристики осадков, относятся конкурирующие электродные процессы, плотность тока, температура и перемешивание.
Если в процессе электроосаждения выделяется газ, обычно получают губчатый и неравномерный осадок. В реакциях катодного осаждения необходимо позаботиться о предотвращении выделения водорода, контролируя потенциал катода или вводя так называемые деполяризаторы. Так, при определении меди деполяризатором является нитрат - ион, превращающийся в ион аммония, что предотвращает выделение газа.

Электролитическое осаждение напоминает химическое осаждение, при котором размер кристалла уменьшается с увеличением скорости образования центров кристаллизации, т.е. с увеличением плотности тока.
В данном случае, однако, желательны кристаллы маленького размера; такие металлические осадки являются плотными, прочными и образуют на электроде тонкозернистые покрытия.
Следует избегать очень высоких плотностей тока, хотя при умеренно высокой плотности обычно получают более удовлетворительные результаты. Очень высокая плотность тока часто приводит к получению нерегулярных осадков с низкой прочностью, образующих на электроде трещиноватые структуры из отдельных пятен. Кроме того высокая плотность тока приводит к возникновению концентрационных поляризаций и образованию газа. Обычно электроаналитические работы выполняются при плотности тока от 0.01 до 0.1 А * см2.
Раствор во время электролиза желательно перемешивать, поскольку это способствует уменьшению концентрационной поляризации.
Хотя температура оказывает существенное влияние на характеристики осадка, предсказать её практически невозможно. Повышение температуры приводит к снижению концентрационной поляризации за счет увеличения подвижности ионов и уменьшения вязкости растворителя. В то же время при повышении температуры из-за снижения перенапряжения может наблюдаться усиление образования газа. Оптимальную температуру для каждого конкретного процесса электролиза можно определить только экспериментально.
Успешное проведение электролитического определения часто зависит от среды, в которой происходит выделение осадка; особенно от pH и присутствия комплексообразующих веществ. От величины pH раствора может зависеть - будет ли определяемый металл полностью выделен на электроде. При работе с такими легко восстанавливающимися веществами, как ионы меди (II) или серебра (I), которые можно без труда количественно выделить в очень кислой среде, не возникает никаких проблем.
|
|
|
При осаждении менее легко восстанавливающихся элементов из кислого раствора одновременно выделяется водород, поэтому, например, для электролитического выделения никеля или кадмия требуется нейтральная или щелочная среда.
Тщательный контроль pH позволяет иногда проводить количественное разделение катионов. Например, в кислых растворах медь легко отделить электролитически от никеля, кадмия или цинка. Даже при очень высокой концентрационной поляризации изменение потенциала катода не будет настолько большим, чтобы не вызвать осаждения других металлов. За счет процесса выделения водорода или восстановления нитрат - иона потенциал катода стабилизируется на более низком уровне, чем требуется для инициирования осаждения этих металлов.
Большинство электрогравиметрических методов основано на восстановлении ионов металла на катоде. Однако иногда в аналитических целях можно использовать осадки выделенные на аноде. Например свинец часто окисляют до диоксида свинца в азотнокислом растворе
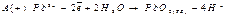
Физические свойства полученного осадка позволяют использовать его в качестве электрогравиметрической формы при определении свинца.
Если раствор, подвергаемый электролизу содержит недостаточное количество азотной кислоты, то одновременно с выделением на аноде диоксида свинца возможно частичное осаждение металлического свинца на катоде. Для предотвращения этого явления к электролиту добавляют концентрированную азотную кислоту (пл. 1.4 г/мл.)
|
|
|


