 |
Примеры решения задач
|
|
|
|
ПРИМЕР 4.1. Вычислите потенциал медного электрода, помещенного в раствор нитрата меди (2), относительно насыщенного хлорсеребряного электрода, если в 150 мл раствора 24,2 г Cu(NO3)2 ·3 H2O.
Решение. Стандартные потенциалы медного электрода 0,345 В, насыщенного хлорсеребряного электрода (ХСЭ) 0,201 В. потенциал медного электрода зависит от концентрации ионов меди (2): E = E0(Cu2+/Cu) + 0,059 /2 lg [Cu2+]
Концентрация меди в растворе:
с(Cu2+) = n / V = m / (M V)
V - объем, в котором растворена навеска, л.
М[Сu(NO3)2] = 241 г / моль; V = 0,150 л, следовательно,
c(Сu2+) = 24,2 / 241,6 · 0,150 = 0,668 моль/л.
Подставив значение концентрации меди (2) в уравнение Нернста, получим
Е(Cu) = 0345 + 0,059 / 2 lg 0,668 = 0,340 B
ЭДС гальванического элемента из медного и насыщеного ХСЭ: Е = E(Cu) - E(ХСЭ) = 0,340 - 0,201 = 0,139 В.
Пример 4.2. Вычислите потенциал водородного электрода в растворе 0,05 М муравьиной кислоты, на 50 % оттитрованной 0,05 М раствором гидроксида калия.
Решение. Уравнение Нернста для водородного электрода
Е = - 0,059 рН, следовательно, вычислим концентрацию ионов водорода в растворе.
В результате протекания реакции
HCOOH + KOH = HCOOK + H2O
в растворе со слабым электролитом НСООН будет находиться соль НСООК. Концентрация ионов водорода, образующихся при диссоциации НСООН, определим по уравнению константы диссоциации
К = [Н+]· [НСОО-] / [HCOOH] = 1,84 · 10-4
В момент, когда кислота оттитрована на 50 %,
[HCOOH] = [HCOO-], следовательно,
[Н+] = К= 1,84 ·10 -4 моль / л.
Потенциал водородного электрода в момент, когда раствор оттитрован на 50 %, равен
Е(2 Н+/ H2) = 0,059 lg 1,84 · 10-4 = - 0,217 B
Пример 4.3. Вычислите потенциал платинового электрода в растворе сульфата железа (2), на 99 % оттитрованного раствором перманганата калия
Решение Потенциал платинового электрода определяется природой сопряженной окислительно-восстановительной пары и концентрацией ее окисленной и восстановленной форм. В данном растворе до точки эквивалентности в растворе пара Fe3+ + e = Fe2+, для которой стандартный потенциал Е0(Fe3+/ Fe2+) = 0,77 B, а уравнение Нернста
|
|
|
Е = Е0(Fe3+/Fe2+) + 0,059 · lg [Fe3+]/[Fe2+].
Поскольку исходный раствор оттитрован на99 %, то [Fe3+]/[Fe2+] = 99 / 1 = 99 =100. Следовательно, потенциал платинового электрода
Е = 0,77 + 0,059 lg 100 = 0,888 B.
Пример 4.4. Вычислить рН раствора, в котором потенциал хингидронного электрода по отношению к нормальному каломельному электроду равен 0,170 в при 20 С.
Решение. Потенциал хингидронного электрода (ЕХГ)
cвязан с концентрацией ионов водорода в растворе или с рН уравнением и при 20 С:
EХГ = 0,699 + 0,058 lg [H+] = 0,699 - 0,058 pH
ЭДС гальванического элемента из хингидронного (ХГ) и каломельного (К) электродов
Е = ЕХГ - ЕК = 0,170 В.
Потенциал каломельного электрода ЕК = 0,282 (по справочнику), следовательно, 0,170 = 0,699 - 0,058 pH - 0,282
pH = 0,699 - 0,282 - 0170) / 0,058 = 4,19.
Пример 4.5. Вычислите потенциал водородного электрода в растворе 0,05 М муравьиной кислоты, на 50 % оттитрованной 0,05 М раствором гидроксида калия.
Решение. Уравнение Нернста для водородного электрода
Е = - 0,059 рН, следовательно, вычислим концентрацию ионов водорода в растворе.
В результате протекания реакции
HCOOH + KOH = HCOOK + H2O
в растворе со слабым электролитом НСООН будет находиться соль НСООК. Концентрация ионов водорода, образующихся при диссоциации НСООН, определим по уравнению константы диссоциации
К = [Н+]· [НСОО-] / [HCOOH] = 1,84 · 10-4
В момент, когда кислота оттитрована на 50 %,
[HCOOH] = [HCOO-], следовательно,
[Н+] = К= 1,84 ·10 -4 моль / л.
Потенциал водородного электрода в момент, когда раствор оттитрован на 50 %, равен
Е(2 Н+/ H2) = 0,059 lg 1,84 · 10-4 = - 0,217 B
Пример 4.6. Вычислите потенциал платинового электрода в растворе сульфата железа (2), на 99 % оттитрованного раствором перманганата калия
Решение Потенциал платинового электрода определяется природой сопряженной окислительно-восстановительной пары и концентрацией ее окисленной и восстановленной форм. В данном растворе до точки эквивалентности в растворе пара Fe3+ + e = Fe2+, для которой стандартный потенциал Е0(Fe3+/ Fe2+) = 0,77 B, а уравнение Нернста
|
|
|
Е = Е0(Fe3+/Fe2+) + 0,059 · lg [Fe3+]/[Fe2+].
Поскольку исходный раствор оттитрован на99 %, то [Fe3+]/[Fe2+] = 99 / 1 = 99 =100. Следовательно, потенциал платинового электрода
Е = 0,77 + 0,059 lg 100 = 0,888 B.
Пример 4.7. Построить интегральную кривую потенциометрического титрования 20 мл 0,02М раствора H2SO4 0,1М раствором КОН.
Решение Переведем молярные концентрации растворов в молярные концентрации эквивалента (Сн) согласно соотношениям:

где См – молярная концентрация раствора, моль / л;
Сн – молярная концентрация эквивалента раствора, моль / л;
f – фактор эквивалентности.

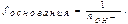 где
где
n H+ – количество ионов Н+, содержащихся в кислоте.
n ОН- – количество ионов ОН–, содержащихся в основании.
Имеем 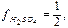

тогда для H2SO4  моль/л
моль/л
для KOH 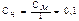 моль/л
моль/л
2. При титровании идет реакция нейтрализации:
Н2SO4 + 2 KOH = K2SO4 + 2 H2O
Н+ + OH- = H2O
C изменением концентрации водородных ионов меняется потенциал индикаторного электрода:
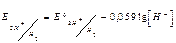
Поскольку  получим
получим
 (4.1).
(4.1).
Для построения кривой титрования, вычисляем потенциал по уравнению (4.1) до точки эквивалентности (разбавлением раствора пренебрегаем).
Так как H2SO4 и КОН являются сильными кислотой и основанием, то концентрации ионов Н+ и ОН- равны молярным концентрациям эквивалента этих растворов, тогда [Н+] = 0.04 моль / л, [ОН-] = 0,1 моль / л.
Для полной нейтрализации кислоты необходимо добавить 8 мл КОН, согласно следующему равенству:
C(H2SO4) *V (H2SO4) = C (KOH) * V(KOH)

1. К началу титрования [Н+] = 0.04 моль/л, тогда Е1 = 0,059* lg 4×10-2 = 0,059* (0,6 – 2) = – 0,0826 В» –83 мВ
2. Добавлено 4 мл щелочи, т.е. оттитровано 50 % кислоты.
Тогда оттитровано
[Н+] = 0.04 * 50/100 = 0,02 моль / л,
осталось кислоты - [Н+] = 0.04 – 0,02 = 0,02 моль / л.
При этом
Е2 = 0,059* lg 0,02 = 0,059* (0,3 – 2) = – 0,1 В» –100 мВ.
3. Добавлено 7,2 мл щелочи, т.е. оттитровано 7.2*100/8 = 90% кислоты, что соответствует концентрации
[Н+] = 0.04*×0,9 = 0,036 моль / л,
осталось кислоты - [H+] = 0,04 – 0,036 = 0,004 моль / л, при этом
Е3 = 0,059* lg 0,004 = 0,059* (0,6 – 3) = – 0,141 В» –141 мВ.
4. Прибавлено 7,92 мл щелочи, т.е. оттитровано  кислоты, или [Н+] = 0.04 * 0,99 = 0,0396 моль / л, осталось кислоты [Н+] = 0.04 – 0,0396 = 0,0004 моль / л.
кислоты, или [Н+] = 0.04 * 0,99 = 0,0396 моль / л, осталось кислоты [Н+] = 0.04 – 0,0396 = 0,0004 моль / л.
|
|
|
При этом
Е4 = 0,059* lg 0,0004 = 0,059* (0,6 – 4) = – 0,2 В» – 200 мВ.
5. Оттитровано 99,9 % кислоты, т.е.
[Н+] = 0.04 * 0,999 = 0,03996 моль / л, осталось кислоты
[Н+ ] = 0.04 – 0,03996 = 0,00004 моль / л.
При этом
Е5 = 0,059* lg 0,00004 = 0,059* (0,6 – 5) = – 0,26 В» – 260 мВ.
Если оттитровано 99,9 % кислоты, следовательно, прилито  щелочи. Объем оставшейся кислоты равен 20 – 19,98 = 0,02 мл, т.е. полкапли.
щелочи. Объем оставшейся кислоты равен 20 – 19,98 = 0,02 мл, т.е. полкапли.
6. При добавлении следующей капли щелочи (её объём 0,04 мл) нейтрализуется оставшаяся кислота и создается избыток щелочи в (0,04 – 0,008 мл) = 0,032 мл или 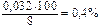
Найдем концентрацию ионов Н+ , когда прилито 8,032 мл щелочи, в этот момент
[ОН–] =  . Поскольку [Н+][ОН–] = 10-14, то при [ОН–] = 4×10- 4, получим
. Поскольку [Н+][ОН–] = 10-14, то при [ОН–] = 4×10- 4, получим
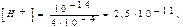 тогда
тогда
Е 6 = 0,059* lg 2,5×10– 11 = 0,059* (0,4 – 11) = – 6,25 В» – 625 мВ.
7. Избыток щелочи составляет 1%, т.е. прилито 8,08 мл. Тогда [ОН–] =  . и [Н+] = 10– 11. При этом
. и [Н+] = 10– 11. При этом
Е 7 = 0,059* lg10– 11 = – 0,649 В» – 649 мВ.
8. Избыток щелочи составляет 10 %, т.е. всего прилито 8,8 мл щелочи.
[ОН-] = 0,1 * 10/100 = 10-2. [Н+] = 10-12.
Е8 = 0.059 * 10-12 = - 0,708 В = - 708 Мв.
На основании полученных результатов строят кривую потенциометрического титрования (рис 4.3).
 Рис. 4.3.
Рис. 4.3.
ПРИМЕР 4.8. Навеску 0,1012г нефелинового концентрата растворили и подготовили для потенциометрического титрования алюминия 0,3Н раствором фторида натрия. По результатам анализа
| Е,В | 0,62 | 0,623 | 0,625 | 0,630 | 0,655 | 0,710 | 0,86 | 0,98 | 1,03 | 1,075 | 1,11 | 1,13 |
| VNaF, ил | 1,0 | 2,0 | 3,0 | 4,0 | 4,5 | 5,0 | 5,5 | 6,0 | 7,0 | 8,0 | 9,0 |
построить интегральную и дифференциальную кривые титрования и определить процентное содержание (по массе) оксида алюминия в нефелиновом концентрате.
РЕШЕНИЕ:
1. Строим интегральную кривую потенциометрического титрования в
координатах E – V (рис. 4.4)
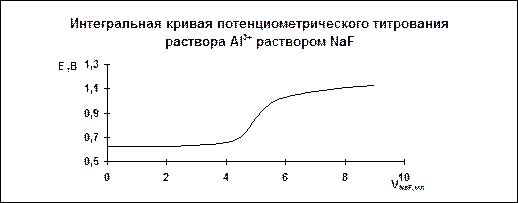 Рис. 4.4.
Рис. 4.4.
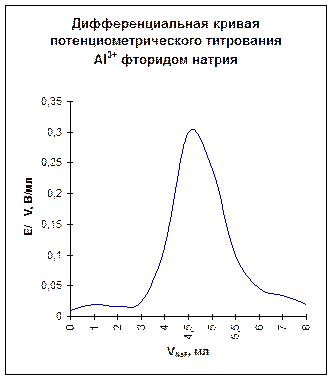
2. Строим дифференциальную кривую титрования в координатах  (рис. 4.5)
(рис. 4.5)
.
| Е, В | V NaF, мл | DE | DV | 
|
| 0,62 | 0,003 | |||
| 0,003 | ||||
| 0,623 | 0,002 | |||
| 0,002 | ||||
| 0,625 | 0,005 | |||
| 0,005 | ||||
| 0,63 | 0,025 | |||
| 0,025 | ||||
| 0,655 | 0,11 | |||
| 0,055 | 0,5 | |||
| 0,71 | 4,5 | 0,3 | ||
| 0,15 | 0,5 | |||
| 0,86 | 0,24 | |||
| 0,12 | 0,5 | |||
| 0,98 | 5,5 | 0,1 | ||
| 0,05 | 0,5 | |||
| 1,03 | 0,045 | |||
| 0,045 | ||||
| 1,075 | 0,035 | |||
| 0,035 | ||||
| 1,11 | 0,02 | |||
| 0,02 | ||||
| 1,13 |
|
|
|
Рис. 4.5.
3. Находим эквивалентный объем раствора фторида натрия, пользуясь графиком, изображенном на рис. 4.5. Эквивалентный объем титранта можно находить по перегибу на интегральной кривой потенциометрического титрования, но в рассматриваемой задаче скачок на прямой получился «размытым».
V экв NaF = 4,5 мл.
4. Рассчитаем титр NaF по Al0.

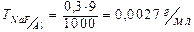
5. Найдем массу алюминия.
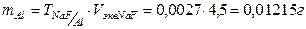
и соответствующее этой массе алюминия количество оксида алюминия:
2Al ––––– Al2O3
2 * 27 г Al ––––– 100 г Al2O3
0,01215 г Al ––––– х г Al2O3.
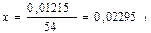 Al2O3
Al2O3
6. Вычислим процентное содержание оксида алюминия в нефелиновом концентрате.
В 0,1012 г технического образца содержится 0,02295 г Al2O3
в 100 г технического образца содержится х г Al2O3
отсюда
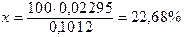 Al2O3
Al2O3
|
|
|


