 |
Задачи для самостоятельного решения.
|
|
|
|
142. Рассчитайте величину потенциала платинового электрода в растворе сульфата железа (2), оттитрованного раствором дихромата калия на 50 %. Концентрация ионов водорода в растворе 1 моль/л.
143. Рассчитайте потенциал стеклянного электрода в растворе с рН 5,0 относительно хлоридсеребряного электрода сравнения. Ответ (- 0,167 В)
144. Потенциал платинового электрода в растворе. содержащем VO2+, VO2+ и 0,01М раствор HCl, равен 0,640 В относительно НКЭ (Енкэ = 0,242 В). Рассчитайте соотношение [VO2+ ] / [ VO2+ ]. (Ответ100:1)
145. Вычислите потенциал алюминиевого электрода, помещенного в раствор, содержащий 27 г хлорида алюминия в 200 мл раствора, относительно стандартного водородного электрода. (Ответ: - 1,66 В)
146. Потенциал стеклянного электрода в буферном растворе с рН 4,00 равен 0,209 при 25 С. Вычислите рН неизвестного раствора, потенциал которого 0,301 В. (5,56)
147. Вычислите потенциал медного электрода, помещенного в раствор, содержащий 16 г. CuSO4 в 1 л. раствора, относительно стандартного водородного электрода. (Ответ:0,316 В).
148. Железный-электрод помещён в раствор, содержащий 20,5 г. FeSO4 ∙7H2O в 100 мл. раствора. Вычислите его потенциал по отношению к нормальному каломельному электроду.
(Ответ: 0,761 В).
149 Платиновый электрод помещён в раствор, содержащий 15,8 г. KМnO4 и 2,23 г. MnSO4 ∙4H2O в 0,5 л. раствора, рН=1. Вычислите потенциал его относительно стандартного Н-электрода.
(Ответ: 1,401В).
150. Потенциал стеклянного электрода в буферном растворе с рН 4,00 равен 0,209 В при 25ºС. Вычислите рН раствора, потенциал которого 0,070 В. (Ответ: 1,67)
151 Рассчитайте потенциал платинового -электрода в растворе FeSO4, оттитрованном раствором K2Cr2O7 на 100%. [H+]= 1 моль/л. Ответ: 1,250 В).
152.Изменение потенциала хлорид-серебряного электрода при концентрациях хлоридов 100, 150,200 мкг/л составило соответственно 3,0, 4,2 и 5,8 мВ. Определите концентрацию Cl- моль/л, если потенциал электрода составляет 6,2 мВ. (Ответ: 225 мкг/л)
|
|
|
153. Рассчитайте потенциал водородного электрода в 0,05М растворе NH4OH, оттитрованном 0,05М раствором HCl на 10%. (Ответ: -0,591В).
154. Вычислите потенциал хингидронного электрода в растворе кислоты с рН=2,0 по отношению к cтандартному водородному электроду. (Ответ: 0,601).
155 Вычислите потенциал серебряного-электрода по отношению к нормальному хлорсеребряному в 10-2М растворе KCl, оттитрованном 10-2 М раствором AgNO3 на 100%. (Ответ:0,279В).
156. ЭДС электрохимической цепи хингидронный электрод
HCOONa // 1M KCl, AgCl/Ag cоставляет 0,006В при 200С. Рассчитайте рН раствора. (Ответ:7,91)
157.Вычислите потенциал цинкового электрода в растворе, содержащем 0,68 г. ZnCl2 и 0,805 г. ZnSO4∙7H2O в 500 мл. раствора относительно каломельного электрода (0,1 н НКЭ) при 20ºС. (Ответ: 1,1628 В)
158. К 0,05 н раствору Pb(NO3)2 прибавили эквивалентное количество KI. Вычислите потенциал Pb-электрода относительно нормального каломельного электрода при 30ºС.(Ответ: 0,5026 В).
150.Вычислите потенциал платинового электрода в 0,1н растворе KMnO4, оттитрованном раствором СrSO4 такой же концентрации на 99%. (Ответ: 1,475В)
160.Вычислите потенциал Cd-электрода в растворе, содержащем 18,8 г. Cd(NO3)2 в 1 л раствора при 25ºС относительно СВЭ. (Ответ: -0,435В).
161.Вычислите потенциал платинового электрода в 0,1н растворе FeSO4, оттитрованном раствором KBrO3 0,1 н в ТЭ. (Ответ:1,330 В)
162. Постройте интегральную кривую потенциометрического титрования 50 мл 0,15 М раствора HC1 0,15Н раствором KOH.
163. Постройте интегральную кривую потенциометрического титрования 25 мл 0.01 М раствора H2SO4 0,15 н раствором NaOH.
164. Вычислите потенциал системы при 25 С в процессе титрования в момент, когда оттитровано 50 % HC1, если титруется 100 мл 0,2Н раствора НС1 0,15Н раствором KOH Ответ: (-0,059В)
Стандартные окислительные потенциалы  относительно стандартного водородного электрода при 25
относительно стандартного водородного электрода при 25 
|
|
|
| Элемент | Высшая степень окисления | +n 
| Низшая степень окисления |  , В , В
|
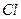


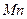





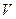
| 

 


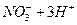







| 




 
 


 + + 

| 

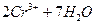




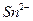






| +1,77 -0,41 +1,33 +0,77 +0,364 +1,51 +0,94 +0,15 0,092 - 0,37 + 1,25 -+ 0,55 - 0,255 0,337 |
ТАБЛИЦА ВАРИАНТОВ КОНТРОЛЬНОГО ЗАДАНИЯ
| № варианта | З | А | Д | А | Ч | И | ||
| Ё39 | ||||||||
| № | З | А | Д | А | Ч | И | ||
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1. Посыпайко. Аналитическая химия и технический анализ. М. 8ысш.шк., 1979.
2..Васильев В.П. Аналитическая химия. В 2 кн. М. Высш.шк., 1989.
Пилипенко А.Т., Пятницкий Ч.В. Аналитическая химия. В 2 кн. М. Химия, 1990.
3. Бончев П.Р. Введение в аналитическую химию. – М. Мир, 1989.
Аналитический контроль металлургического производства. М. Металлургия, 1995.
5. Карпов Ю.А. Аналитический контроль в металлургии. М.: ИКЦ Академкнига, 2002.
|
|
|
6. Ляликов Ю.С. Физико-химические методы анализа. 5-е издание,
. переработанное и дополненное. Москва. 1974.
7. Крешков А.П. Основы аналитической химии. В 3 т. Т.2. Количественный анализ. Т.3 Физические и физико-химические (инструментальные) методы анализа. М.: Химия, 1970
8. Скуг Г., УЭСТ Д. Основы аналитической химии. Том 1,2. «Мир». Москва. 1979.
9. Практикум по физико-химическим методам анализа. Под редакцией Петрухина О.М. Москва. Химия. 1987.
10. Сборник вопросов и задач по аналитической химии. Под редакцией Васильева В.П. Москва. Высшая школа. 1976. 215с.
11. Задачник по аналитической химии / Н.Ф.Клещев и др. - М.: химия,1993.- 224 с.
СОДЕРЖАНИЕ
1. Гравиметрический анализ
2.Титриметрический анализ
2.1.Способы выражения концентрации растворов
2.2.Расчет результатов анализа
2. 3.Кислотно-основное титрование
Вычисление молярных масс эквивалентов в методе кислотно- основного титрования
Вычисление рН при титровании
Задачи для самостоятельного решения
2.4.ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ ТИТРОВАНИЕ
ВЫЧИСЛЕНИЯ В РЕАКЦИЯХ ОКИСЛЕНИЯ - ВОССТАНОВЛЕНИЯ
. Расчет эквивалентной массы вещества 28
Расчет концентрации рабочих растворов
Вычисление результатов анализа
Расчет окислительно-восстановительных потенциалов
Задачи для самостоятельного решения
3. Электрогравиметрический анализ
5. Потенциометрический анализ
Стандартные окислительно -восстановительные потенциалы
Рекомендуемая литература
|
|
|


