 |
Задачи для самостоятельного решения
|
|
|
|
81. Навеска 0,09 г образца технического сульфида натрия растворена в воде. На титрование этого раствора пошло 18,2 мл раствора, содержащего 0,0132 г/мл йода. Вычислите массовую долю  в образце?
в образце?
82. При анализе препарата хлорида железа (II) получены следующие данные: навеска 0,2658 г;  = 0,003620 г/мл; израсходовано 23,48мл раствора
= 0,003620 г/мл; израсходовано 23,48мл раствора 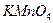 . Вычислить массовую долю
. Вычислить массовую долю  в образце?
в образце?
83. Для установки титра 0,1н  взято 0,119 г
взято 0,119 г  . Можно ли вести титрование этой навески из бюретки вместимостью 50 мл?
. Можно ли вести титрование этой навески из бюретки вместимостью 50 мл?
84. На титрование сурьмы (III) содержащейся в 1,08 г минерала стибнита пошло 41,6 мл 0, 0653н раствора  . Рассчитайте массовую долю сурьмы в образце.
. Рассчитайте массовую долю сурьмы в образце.
85. К навеске 0,12 г 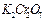 добавили
добавили  и соляной кислоты, выделившийся
и соляной кислоты, выделившийся  оттитровали 22,85 мл раствора
оттитровали 22,85 мл раствора  . Найти титр
. Найти титр  по йоду.
по йоду.
86. При анализе навески в 0,2435 г доломита,  был выделен в виде
был выделен в виде  , на титрование которого пошло 42,2 мл раствора KMnO4,
, на титрование которого пошло 42,2 мл раствора KMnO4, 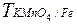 = 0,005139. Вычислите массу
= 0,005139. Вычислите массу  содержится в доломите?
содержится в доломите?
87. Мышьяк (III) встречается в природе в виде минерала клаудетита. На титрование 0,210 г минерала израсходовано 29,3 мл 0,052н раствора  . Рассчитайте массовую долю
. Рассчитайте массовую долю  в образце.
в образце.
 .
.
88 Навеска 0,1627 г образца известняка растворена в кислоте. Из полученного раствора кальций осажден в виде оксалата. Осадок отфильтрован, промыт и растворен в соляной кислоте. На титрование полученного раствора потребовалось 31,42 мл раствора 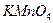 , в 1 мл которого содержится 0,002930 г
, в 1 мл которого содержится 0,002930 г 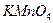 . Вычислите массовую долю
. Вычислите массовую долю  в известняке.
в известняке.
89. Водный раствор, содержащий 0,0921 г хромового ангидрида обработан раствором  , подкислен соляной кислотой и оттитрован 23,75 мл раствора тиосульфата натрия (
, подкислен соляной кислотой и оттитрован 23,75 мл раствора тиосульфата натрия ( =0,011354 г/мл). Вычислите массовую долю
=0,011354 г/мл). Вычислите массовую долю  образце?
образце?
90. Рассчитайте степень чистоты (в %) пробы, загрязненной  , если для титрования 0,4 г этого вещества требуется 28,6 мл раствора
, если для титрования 0,4 г этого вещества требуется 28,6 мл раствора 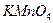 , 1 мл которого содержит 5,98 мг
, 1 мл которого содержит 5,98 мг 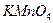 .
.
|
|
|
91. Для определения  в цементе навеска 0,4068 г образца переведена в раствор. После отделения кремниевой кислоты железо восстановлено до
в цементе навеска 0,4068 г образца переведена в раствор. После отделения кремниевой кислоты железо восстановлено до  и на его титрование израсходовано 12,75 мл
и на его титрование израсходовано 12,75 мл 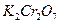 (
( =0,0005585 г/мл). Вычислите массовую долю
=0,0005585 г/мл). Вычислите массовую долю  в образце.
в образце.
92. Для определения оксидов азота  в растворе азотной кислоты (пл.1,344 г/мл), на титрование 10 мл 0,1015н раствора
в растворе азотной кислоты (пл.1,344 г/мл), на титрование 10 мл 0,1015н раствора 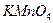 в кислой среде до обесцвечивания было израсходовано 20,35 мл анализируемой кислоты. Вычислите массовую долю
в кислой среде до обесцвечивания было израсходовано 20,35 мл анализируемой кислоты. Вычислите массовую долю  в образце.
в образце.
93. 0,1510 г хлората калия растворили и обработали 100,00 мл 0, 95. Навеску стали массой 0,2548 г. с содержанием марганца 1,09 % растворили, окислили марганец до  и оттитровали 18,50 мл. раствора
и оттитровали 18,50 мл. раствора  . Рассчитайте нормальность раствора
. Рассчитайте нормальность раствора  и его титр по
и его титр по 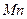 .
.
94 Какую массу руды, содержащей около 60%  , следует взять для анализа, чтобы, после соответствующей обработки, на титрование полученной соли железа (II) израсходовать 20,00мл. 0,1н. раствора
, следует взять для анализа, чтобы, после соответствующей обработки, на титрование полученной соли железа (II) израсходовать 20,00мл. 0,1н. раствора
95.. Навеска образца железной проволоки 1,0230г растворена без доступа воздуха в серной кислоте. Раствор разведён до метки в мерной колбе объёмом 250мл. На титрование 25мл полученного раствора расходуется 17,8 мл раствора 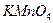 . Вычислите массовую долю железа в образце, если
. Вычислите массовую долю железа в образце, если  .
.
96 На титрование раствора оксалата аммония расходуется 28,15мл раствора  . Вычислите массу
. Вычислите массу  в образце.
в образце.
97. 15,9900 г. железного купороса растворили в мерной колбе ёмкостью 500 мл. На титрование 25мл раствора расходуется 27,80 мл раствора перманганата калия  . Вычислите массовую долю (%)
. Вычислите массовую долю (%)  в образце.
в образце.
98. 0,9432 г сульфида натрия растворили в мерной колбе ёмкостью 200 мл, на титрование 20 мл этого раствора расходуется 15,42мл 0,1204н рабочего раствора йода. Вычислите массовую долю (%)  в образце.
в образце.
99. 0,3595г сульфита натрия растворили в произвольном объёме воды. Полученный раствор оттитровали рабочим раствором йода  . На это его расходуется 28,65 мл. Вычислите массовую долю (%)
. На это его расходуется 28,65 мл. Вычислите массовую долю (%)  в образце.
в образце.
100. Из 3,2057 г сплава осадили свинец в виде  . Действием на осадок кислоты и
. Действием на осадок кислоты и  выделили
выделили  , на титрование которого пошло 9,15 мл 0,1028н
, на титрование которого пошло 9,15 мл 0,1028н  . Вычислите массовую долю
. Вычислите массовую долю  в сплаве.
в сплаве.
|
|
|
Задачи №№ 101 -120
При титровании к объему V1мл раствора вещества А с молярной концентрацией эквивалента С1 добавили раствор вещества В с молярной концентрацией эквивалента С2. Рассчитайте потенциал в точках, соответствующим добавленному объему раствора В: а) 25 мл, б) 50 мл, в) 51мл.
Данные к задачам №№ 101 - 110
.
| За-дача | В-во А | V1,мл | C1, Моль/ | B - во В | C2, Моль/ | Примеча-ние |
| VCl2 | 0,10 | SnCl4 | 0,10 | V2+ → V3+ | ||
| Fe(CN)63- | 0,10 | CrCl2 | 0,10 | Cr2+→ Cr3+ | ||
| Fe(CN)63- | 0,10 | TiCl3 | 0,10 | |||
| FeCl3 | 0,10 | SnCl2 | 0,10 | |||
| UCl4 | 0,01 | KMnO4 | 0,01 | U4+→UO2+ | ||
| SnCl2 | 0,01 | FeCl3 | 0,01 | |||
| TiCl2 | 0,01 | SnCl4 | 0,01 | Ti2+ →Ti3+ | ||
| FeCl2 | 0,10 | KМnO4 | 0,10 | |||
| FeCl2 | 0,10 | K2Cr2O7 | 0,10 | |||
| TlCl | 0,10 | CeCl4 | 0,10 | Tl+ → Tl3+ Се4+→Се3+ |
Задачи №№ 110- 120
Рассчитайте потенциал в точке эквивалентности и скачок  при титровании в кислой среде
при титровании в кислой среде  V1мл раствора вещества А с молярной концентрацией эквивалента С1 раствором вещества В с молярной концентрацией эквивалента С2.
V1мл раствора вещества А с молярной концентрацией эквивалента С1 раствором вещества В с молярной концентрацией эквивалента С2.
.
Данные к задачам №№ 111- 120
| Задача | В -во А | V1, мл | С1, моль/ | В - во В | С2, моль/л | Примечание |
| FeCl2 | 0,1 | K2Cr2O7 | 0,1 | |||
| TlCl3 | 0,1 | VCl3 | 0,1 | Tl3+ → Tl+ | ||
| UCl4 | 0,1 | KMnO4 | 0,1 | |||
| TiCl2 | 0,1 | SnCl4 | 0,1 | Ti2+ → Ti3+ | ||
| TlCl | 0,1 | CeCl4 | 0,1 | Tl+ → Tl3+ Ce4+→ Ce3+ | ||
| FeCl3 | 0,01 | SnCl2 | 0,01 | |||
| FeCl2 | 0,1 | CeCl4 | 0,1 | Ce4+→ Ce3+ | ||
| TiCl3 | 0,1 | KMnO4 | 0,1 | Ti3+→ TiO2+ | ||
| HNO2 | 0,1 | KMnO4 | 0,1 | |||
| MnSO4 | 0,1 | K2Cr2O7 | 0,1 |
|
|
|


