 |
Уравнение Бойля-Мариотта и Гей-Люссака
|
|
|
|
 ;
;
где V – объем газа, измеренный при реальных условиях, т.е. при атмосферном давлении Р и температуре Т; V0 – объем газа при нормальном давлении Р0 и температуре Т0. Используют для приведения объема к нормальным условиям.
2. Закон Авогадро: в равных объемах разных газов при одинаковом давлении и температуре содержится одинаковое число молекул. В одном моле содержится 6,022·1023 молекул (число Авогадро).
При нормальных условиях(T= 273К, p = 101,325 кПа или 760 мм рт.ст.) моль любого газа занимает объем 22,4 л. Теперь несложно рассчитать молярные объемы эквивалентов наиболее распространенных в реакциях газов Н 2 и О 2. Один моль Н 2 (2г) занимает объем 22,4 л, а один эквивалент Н 2 (1г) – V л, следовательно, Vэ(Н 2) = 11,2 л/моль. Аналогичным образом рассчитывается Vэ(О 2) = 5,6 л/моль.
3. Молярную массу газа можно вычислить, пользуясь уравнением Клапейрона - Менделеева:
 , или
, или  ,
,
где Р – давление, Па; V – объем, м3; m- масса, г; М – молярная масса, г/моль; R – универсальная газовая постоянная, равная 8,314 Дж/(моль . К); Т – абсолютная температура, К.
4. Из закона Авогадро следует, что при одном и том же давлении и температуре массы равных объемов газов относятся как их молярные массы:
 , или D =
, или D = 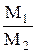
где D = m1/m2 - относительная плотность D первого газа по второму,
m1 – масса первого газа, m2 – масса второго газа.
Закон Дальтона (закон парциальных давлений).
Парциальным давлением (po) газа в смеси называется давление, которое производил бы этот газ, занимая при тех же физических условиях объем всей газовой смеси.
Согласно закону: общее давление смеси газов, не вступающих друг с другом в химическое взаимодействие, равно сумме парциальных давлений газов, составляющих смесь.

|
|
|
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.
Оборудование: эвдиометр, штатив, колба, соединительные трубки, кристаллизатор, термометр, барометр, соляная кислота (HCl 1:2), таблетка цинка.
Метод основан на измерении объема водорода, который выделяется из кислоты при действии на нее металла.
Zn + 2HCl = ZnCl2 + H2
ХОД РАБОТЫ:
1. Собрать установку так, как показано на рисунке 1. Для этого:
- в кристаллизатор налить 1/2 объема воды;
- заполнить водой эвдиометр и установить его в штативе так, чтобы в него не попадал воздух;
2. Налить в реакционную колбу 10-15 мл соляной кислоты.
3. Взвесить кусочек цинка и положить на горлышко колбы, колбу закрыть пробкой с газоотводной трубкой, проверить герметичность системы, а затем колбу поставить в вертикальное положение, чтобы цинк упал в кислоту.
4. После полного растворения цинка в кислоте, измерить объем выделившегося водорода.

| Рис. 1. Газометрический прибор: 1 – эвдиометр, заполненный водой; 2 -штатив; 3 – кристаллизатор с водой; 4 – реакционная колба; 5 – соединительная трубка; 6 – раствор соляной кислоты; 7 – цинк. |
ОФОРМЛЕНИЕ РАБОТЫ:
1. Зарисовать установку для определения молярной массы эквивалента цинка.
2. Написать уравнение реакции.
3. Записать экспериментальные данные:
· m (Zn) – масса цинка, г;
· V – объем выделившегося водорода, дм3;
· t oC – комнатная температура, С;
· Т – комнатная температура, К;
· P – атмосферное давление по барометру в лаборатории, кПа;
· р  - давление насыщенного водяного пара при данной комнатной температуре (определить по таблице 1);
- давление насыщенного водяного пара при данной комнатной температуре (определить по таблице 1);
·  = P - р
= P - р  - давление водорода в эвдиометре, при данной комнатной температуре.
- давление водорода в эвдиометре, при данной комнатной температуре.
· Гидростатическим давлением водного столба пренебрегаем.
Таблица 1
Парциальное давление водяного пара в зависимости от температуры воздуха
| Температура, 0С | Давление водяного пара, | Температура, 0С | Давление водяного пара, | Температура, 0С | Давление водяного пара, | |||
| мм рт.ст | кПа | мм рт.ст | кПа | мм рт.ст | кПа | |||
| 9,8 | 1,317 | 14,5 | 1,929 | 21,1 | 2,793 | |||
| 10,5 | 1,397 | 15,5 | 2,064 | 22,4 | 2,966 | |||
| 11,2 | 1,490 | 16,5 | 2,195 | 23,8 | 3,153 | |||
| 11,9 | 1,583 | 17,5 | 2,328 | 25,2 | 3,352 | |||
| 12,6 | 1,702 | 18,7 | 2,474 | 26,7 | 3,551 | |||
| 13,6 | 1,809 | 19,8 | 2,633 | 28,1 | 3,764 |
4. Рассчитать молярную массу эквивалента цинка.
|
|
|
|
|
|


