 |
Контрольные Вопросы по ТЕМЕ. Задания для I этапа зачёта. (напишите структурные формулы следующих соединений). Дисахариды
|
|
|
|
Контрольные вопросы ПО ТЕМЕ
1. Что называют сложным углеводами? Как классифицируют сложные углеводы?
2. Каков состав и строение дисахаридов (мальтоза, целлобиоза, лактоза, сахароза) В чем заключается их биологическое значение?
3. Каковы свойства дисахаридов (цикло-оксо-таутомерия; восстановительная способность; мутаротация; гидролиз)? Как записать уравнения реакций?
4. Какие полисахариды относят к гомополисахаридам? Как записать биозный фрагмент гомополисахаридов?
5. Какие полисахариды относят к гетерополисахаридам? Как записать фрагмент гиалуроновой кислоты?
7. Как записать реакции гидролиза полисахаридов?
ЗАДАНИЯ для I ЭТАПА ЗАЧЁТА
(Напишите структурные формулы следующих соединений)
Дисахариды
Мальтоза, целлобиоза, лактоза, сахароза.
Полисахариды
Биозный фрагмент крахмала (амилозы), биозный фрагмент целлюлозы, амилоза, крахмал, целлюлоза, фрагмент гиалуроновой кислоты.
Напишите уравнение следующих реакций с указанием механизма
· Гидролиз мальтозы, целлобиозы, лактозы, сахарозы.
· Цикло-оксо-таутомерия на примере мальтозы.
Тема
α -аминокислоты. Пептиды. Белки.
План занятия
1. Проверка посещаемости и информация
2. Устный опрос и коррекция знаний
3. Лабораторная работа № 7
4. Решение ситуационных задач
5. Подведение итогов занятия
Учебные элементы темы
 α –Аминокислоты – это гетерофункциональные соединения. Они содержат одновременно карбоксильную и аминогруппу , которые находятся у одного и того же α –углеродного атома:
α –Аминокислоты – это гетерофункциональные соединения. Они содержат одновременно карбоксильную и аминогруппу , которые находятся у одного и того же α –углеродного атома:
Классифицируют α –аминокислоты различным образом:
I. По химической природе радикала:
|
|
|
Ациклические (алифатические):
 |
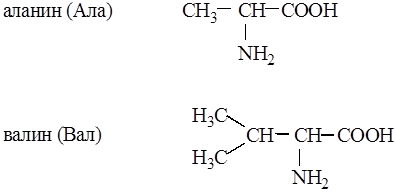 |
Циклические:
 |
II. По наличию функциональных групп или по кислотно–основным свойствам:
Моноаминомонокарбоновые, или нейтральные – все кислоты, указанные выше.
Моноаминодикарбоновые, или кислые:
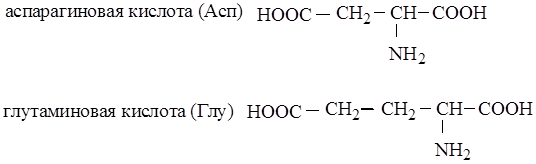 |
Диаминомонокарбоновые, или оснó вные:
 |
III. По полярности радикалов:
Неполярные. В радикалах не содержатся дополнительные функциональные группы. Это алифатические аминокислоты.
Полярные. В радикалах содержатся дополнительные функциональные группы – ОН, SH, S и др.
 |
Приведенные классификации достаточно условны, так как одна и та же кислота может быть отнесена к различным группам.
Медико–биологическое значение α –аминокислот обусловлено тем, что они занимают ключевое положение в азотистом обмене. Реакции комплексообразования аминокислот играют чрезвычайно важную роль в поддержании металло–лигандного гомеостаза, а также в хелатотерапии.
Многие из α –аминокислот используются как лекарственные средства, влияющие на тканевой обмен. Так, глутаминовая кислота применяется для лечения заболеваний центральной нервной системы; метионин и гистидин – для лечения и предупреждения заболеваний печени; цистеин – глазных болезней. Кроме того, цистеин является эффективным антиоксидантом, выполняя защитные функции при воздействии на организм сильных окислителей, благодаря восстановительным свойствам тиольной группы –SH. В то же время цистеин был первым препаратом, проявившим противолучевое действие. Он уменьшал степень лучевого поражения и повышал выживаемость больных.
Ряд заболеваний, чаще всего врожденных, связаны с неспособностью данного организма синтезировать некоторые α –аминокислоты. Например, при фенилкетонурии человеческий организм не синтезирует тирозин, который у здоровых людей образуется из фенилаланина. Но главная биологическая роль α –аминокислот состоит в том, что они являются структурными единицами (мономерами) белков.
|
|
|
Пептиды и белки – это природные или синтетические полимеры. Они построены из остатков α –аминокислот, соединенных пептидными или амидными связями. Пептиды имеют меньшую молекулярную массу, чем белки. Условно считают, что пептиды содержат в молекуле до 100, а белки – свыше 100 аминокислотных остатков. Молекулярная масса пептидов – до 10 тысяч; белков – от 10 тысяч до нескольких миллионов. В свою очередь пептиды подразделяют на олигопептиды и полипептиды. Олигопептиды включают до 10, а полипептиды – от 10 до 100 остатков аминокислот.
Ввиду многообразия пептидов и белков их классифицируют различным образом: по составу, пространственному строению, биологическим функциям.
По составу белки подразделяют на простые и сложные.
Простые белки гидролизуются с образованием только α –аминокислот.
Сложные белки кроме белковой части, состоящей из α –аминокислот, содержат также органическую или неорганическую часть небелковой природы. Эта небелковая часть молекулы называется " простетическая группа".
По типу простетической группы различают: гемопротеины, в которых белковая часть глобин соединена с простетической группой гемом (гемоглобин, миоглобин); фосфопротеины, которые в качестве простетической группы содержат остаток фосфорной кислоты; металлопротеины – ионы металла.
К сложным белкам также относят смешанные биополимеры. Их молекулы кроме белковой части могут содержать простетическую группу липидного характера (липопротеины), углеводного характера (гликопротеины) и т. д.
По пространственной структуре белки делят на глобулярные и фибриллярные.
Глобулярные белки растворяются в воде и солевых растворах с образованием коллоидных систем. Для них более характерна α –спиральная структура. Их макромолекула имеет форму сферы. Это яичный белок, миоглобин, почти все ферменты.
Фибриллярные белки часто имеют волокнистое строение, не растворяются в воде. Для них более характерна β –структура. К ним относят: кератин волос и роговой ткани; миоинозин мускульной ткани; коллаген соединительной ткани.
|
|
|
|
|
|


